Que es la alcalinidad?

La alcalinidad es uno de los factores más importantes en la química del agua y equilibrio del ISL, puede aprender más acerca del ISL en este artículo, Pero, qué es la alcalinidad en sí? La alcalinidad total (AT) a menudo se confunde con el pH y palabras como álcali, alcalino, etc. Es un factor muy mal entendido a pesar que cualquier persona que está involucrado con piscinas tiene que manejarlo dia con dia o semana tras semana. En este artículo explicamos qué es la alcalinidad, para que nos sirve y porqué es tan importante en el ISL, y brevemente su relación con el pH, más acerca de esa relación aquí.
¿Qué es la alcalinidad? ¿Qué hace en la química del agua? ¿Y en qué se diferencia la alcalinidad del pH? ¿Y cuál es el pH y la alcalinidad ideales para una piscina? O el tema no se ha explicado claramente, o... ni siquiera se ha explicado. Esperamos que este artículo simplifique la ciencia y lo ayude a comprender mejor la alcalinidad.
¿Qué es la alcalinidad?
La alcalinidad es una medida de todas las sustancias alcalinas disueltas en agua (aquellas con pH superior a 7.0). Las cuales tienen la capacidad de neutralizar los ácidos que se agregan en la piscina. Hay tres tipos principales:
- Bicarbonato
- Carbonato
- Hidróxidos
El agua pura, con un pH de 7.0, tiene el equilibrio perfecto de iones de hidrógeno. Sus moléculas (H2O) se disocian en una cantidad igual de iones de hidrógeno e hidróxido en un porcentaje muy pequeño. La química se ve así:
H 2 O ⇌ H + + OH -
La alcalinidad se puede calcular usando esta fórmula (no se preocupe, no se lo tiene que memorizar):
Alk = [HCO3 -] + 2 [CO3 -2] + [OH-] - [H+]
El pH es clave
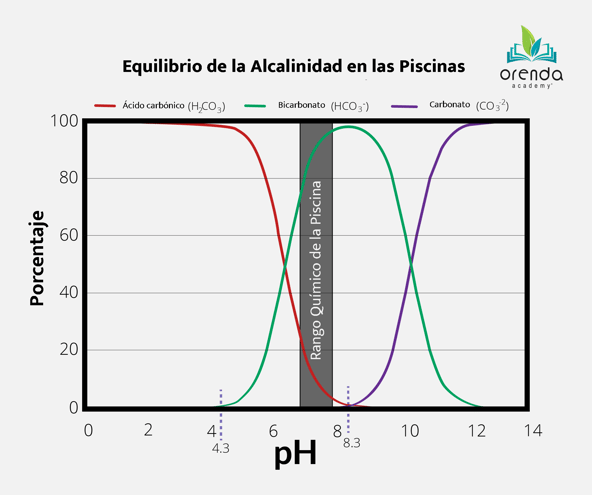
El pH del agua establece los porcentajes de alcalinidad en el agua de las piscinas. En la siguiente tabla mostramos los porcentajes según sea el pH en dado momento.
Analicemos el lado izquierdo de la gráfica. El ácido carbónico es simplemente dióxido de carbono disuelto en agua (CO2). Al 4.3 de pH es el punto donde la alcalinidad comienza a existir en el agua. Cualquier cosa por debajo de 4.3 de pH, y hay cero alcalinidad en el agua; se ha terminado de disolver el CO2. Esencialmente, a un pH de 4.3, el ácido carbónico comienza a convertirse en iones de bicarbonato, indicado por la línea roja en el gráfico. Generalmente una piscina se mantiene entre 7.2 y 7.8 de pH, lo cual es alcalinidad de bicarbonato en su mayoría.
Pero qué pasa cuando se sube mas el pH? A un pH de 8.3, aparecen iones de carbonato y la transición ocurre de iones de bicarbonato a carbonato. Los hidróxidos disueltos no se muestran en el gráfico, por que estos no aparecen hasta que el pH llega a un nivel alrededor de 12, lo cual nunca ocurre en las piscinas. El hidróxido más común en las piscinas es el hidróxido de calcio, que sale del recubrimiento de curado, y su pH individual es de 12.6. Según el Consejo Nacional de Yeseros, el hidróxido de calcio es la razón número 1 por la que el pH y la alcalinidad aumentan durante el arranque o llenado inicial de una piscina.
Como puede ver, el pH controla el tipo de sustancias alcalinas presentes en el agua (y el porcentaje de cada una).
¿Qué hace la alcalinidad en la química de la piscina?
La alcalinidad amortigua (estabiliza) el pH del agua neutralizando los ácidos. Hace que sea más difícil que el pH fluctúe o baje su nivel, y también es un factor positivo que contribuye al Índice de Saturación de Langelier (también conocido como ISL o índice de corrosión).
Técnicamente, la alcalinidad amortigua el pH al proporcionar o absorber un ion de hidrógeno (H +) según sea necesario. Entonces, cuando se agrega ácido, los iones de carbonato pueden absorber hidrógeno para crear iones de bicarbonato y si se agrega a un mas acido esos iones de bicarbonato absorben hidrógeno una vez más para convertirse en ácido carbónico. Este es un equilibrio, al igual que el pH, por lo que también puede ir a la inversa. La reacción química ocurre de la siguiente manera:
CO3-2 + H+ ↔ HCO3- + H+ ↔ H2CO3
Necesitamos esta alcalinidad disuelta en nuestra agua para mantener equilibrado el índice de saturación y estabilizar nuestro pH. El nivel ideal de AT depende del tipo de desinfectante utilizado, pero generalmente oscila entre 80 y 120 ppm. Lo que realmente importa, en nuestra opinión, es el balance general del ISL del agua. Es factible tener agua equilibrada con 60 ppm de AT, siempre que la compense con agua más cálida, pH más alto o niveles de calcio más altos.
En la química de la piscina, los desinfectantes, los sistemas de sal y, por supuesto, los ajustadores de pH (como el ácido y el bicarbonato de sodio) impactan el pH. Pero la alcalinidad debe aumentarse con bicarbonato de sodio o carbonato de sodio y reducirse con ácido.
Inyectar CO2 en la piscina, disminuye el pH creando directamente ácido carbónico, (ya que el CO2 reacciona con el H2O) pero no afecta la alcalinidad del agua, puede leer mas al respecto en este detallado artículo. Por otra parte el ácido reduce el pH y la alcalinidad. En las piscinas residenciales, el mal uso del ácido genera tantos problemas que es nuestro mal hábito número 1 a evitar, entre otros. En piscinas comerciales, el ácido se alimenta usando bombas de alimentación automatizadas (o temporizadas). Sin embargo, si la piscina alimenta el ácido sin diluirlo previamente, es probable que tengan dificultades para mantener niveles de alcalinidad decentes.
En este artículo le contamos cómo usar un alimentador de ácido en una piscina.
Alcalinidad de cianurato
 Para que el ISL se calcule correctamente, tenemos que encontrar la alcalinidad del carbonato eliminando la alcalinidad del cianurato. Para hacer esto, tenemos que medir el ácido isocianúrico (CYA) y conocer el pH. Cuanto mayor sea el CYA, más severo será el impacto en el ISL.
Para que el ISL se calcule correctamente, tenemos que encontrar la alcalinidad del carbonato eliminando la alcalinidad del cianurato. Para hacer esto, tenemos que medir el ácido isocianúrico (CYA) y conocer el pH. Cuanto mayor sea el CYA, más severo será el impacto en el ISL.
De acuerdo con el manual de capacitación básica de IPSSA, puede corregir la alcalinidad tomando 1/3 del nivel de CYA y restándolo del nivel de AT. Para ser exactos, necesitará conocer el pH del agua, pero como las piscinas generalmente tienen un pH entre 7.2 y 7.8, puede acercarse con el uso de 1/3. Pero no se preocupe, la calculadora de la aplicación Orenda realizará automáticamente la corrección exacta para usted y será precisa. Así es como se ve la ecuación:
Alcalinidad corregida (AC) = AT ppm - (CYA ppm x [factor de corrección a ese pH])
AC = 100 ppm - (90 ppm x [factor de corrección @ 7.6 pH])
AC = 100 ppm - (90 ppm x [0.33])
AC = 100 ppm - (30 ppm)
AC = 70 ppm
¿Cuál es la diferencia entre pH y alcalinidad?
 Si quiere un artículo extenso, lo puede encontrar aquí. En resumen, el pH es el poder del hidrógeno, o el potencial del hidrógeno. Es una escala logarítmica de 0 a 14, donde 7.0 es neutral. Mide la concentración de hidrógeno para determinar qué tan ácida (por debajo de 7.0) o alcalina (por encima de 7.0) es una sustancia.
Si quiere un artículo extenso, lo puede encontrar aquí. En resumen, el pH es el poder del hidrógeno, o el potencial del hidrógeno. Es una escala logarítmica de 0 a 14, donde 7.0 es neutral. Mide la concentración de hidrógeno para determinar qué tan ácida (por debajo de 7.0) o alcalina (por encima de 7.0) es una sustancia.
Medimos la alcalinidad en partes por millón y el pH en su propia escala (como el ISL). En otras palabras, el pH no nos dice cuánto ácido o álcali se disuelve en agua, solo nos dice en qué parte del equilibrio está el pH general. Cuanto mayor es la alcalinidad, más difícil es que cambie el pH, debido a la capacidad del agua para neutralizar el ácido. Si quiere aprender a manejar el ácido de su piscina, puede ir aqui.
Si tiene un pH alto en el agua de la piscina, o se pregunta por qué su pH sigue subiendo, hay varias razones posibles de las cuales platicamos en este otro artículo. Ciertas cosas también pueden bajar el pH, por supuesto. Mientras que la alcalinidad se trata de álcali disuelto en el agua que puede tomar o dar hidrógeno, el pH es aproximadamente la concentración de ese hidrógeno. Lo crea o no, se trata principalmente del comportamiento del dióxido de carbono (CO2).
Más investigación
Para aprender más en profundidad, puede seguir leyendo mis fuentes de informacion. Mis fuentes principales fueron:
- Manual de capacitación básica de IPSSA, edición revisada 2016. Por Robert W. Lowry
- La importancia de las relaciones químicas generales en el tratamiento del agua. Por Mealy y Bowman, Wisconsin DNR
- Estudio e interpretación de las características químicas del agua natural. Servicio Geológico de EE. UU.
- Disociación de agua y pH. Por Martin Chaplin
- Alcalinidad y relaciones de pH. Por James McDonald, PE, CWT
- Curso de certificación de inicio, Consejo Nacional de Yeseros. Por Greg Garrett