Alcalinidad de carbonato y corregida

El ISL se maneja en base a la alcalinidad de carbonato del agua de la piscina... pero este puede ser un término confuso. Los kits de prueba de piscina, desafortunadamente solo miden la alcalinidad total. Entonces, ¿Cual es la alcalinidad de carbonato? ¿Y en qué se diferencia de la alcalinidad total? Como nosotros mismos lo descubrimos, la semántica realmente importa en este tema en particular. Si aún no sabe nisiquiera que es la alcalinidad, tal vez debería empezar ahí.
Cubierto en este artículo:
- ¿Qué es la alcalinidad de carbonato?
- Alcalinidad corregida
- Iones de carbonato
- Cómo calcular la alcalinidad corregida y de carbonato
- Ecuación de alcalinidad corregida
- Concentración de iones carbonato
- Sistema de amortiguación de alcalinidad
- El bicarbonato y el carbonato se forman a raíz del CO2
- Conclusión
¿Qué es la alcalinidad de carbonato?
Empezaremos por aliviar algo de frustración. Dos cosas diferentes se denominan como "alcalinidad de carbonato" en la química del agua: iones de carbonato e iones de bicarbonato y carbonato juntos. Nos gustaría distinguirlos y ofrecer un cambio de nombre para uno de ellos para minimizar la confusión. Por la presente apoyamos el término alcalinidad corregida cuando nos referimos a lo que exige la fórmula del índice de saturación de Langelier (ISL) .

Alcalinidad corregida
La alcalinidad corregida se refiere tanto a la alcalinidad del bicarbonato como al carbonato, pero nada más. Esta "corrección" significa ajustar conforme al ácido isocianúrico, que contribuye a la alcalinidad total como alcalinidad del isocianurato. La forma más sencilla de calcularlo es utilizando la aplicación gratuita de Orenda, que hace todos los cálculos por usted; simplemente ingrese el pH, la alcalinidad total y el estabilizador (CYA) de su agua en la calculadora, y el valor del ISL se ajustará en consecuencia. Pero por el bien de la educación, cubrimos cómo calcular la alcalinidad corregida más adelante en este artículo.
Es la alcalinidad corregida como la mayoría de las personas le conocen a la "alcalinidad de carbonato", gracias a la fórmula del ISL. Pero técnicamente hablando, los iones de carbonato son solo un subconjunto de ese grupo, y se les llama alcalinidad de carbonato.
Iones de carbonato
Una vez que el pH alcanza 8,3, los iones bicarbonato (HCO3-) dejan su Hidrógeno y se convierten en iones carbonato (CO3-). Esto se muestra en la tabla de equilibrio de alcalinidad:
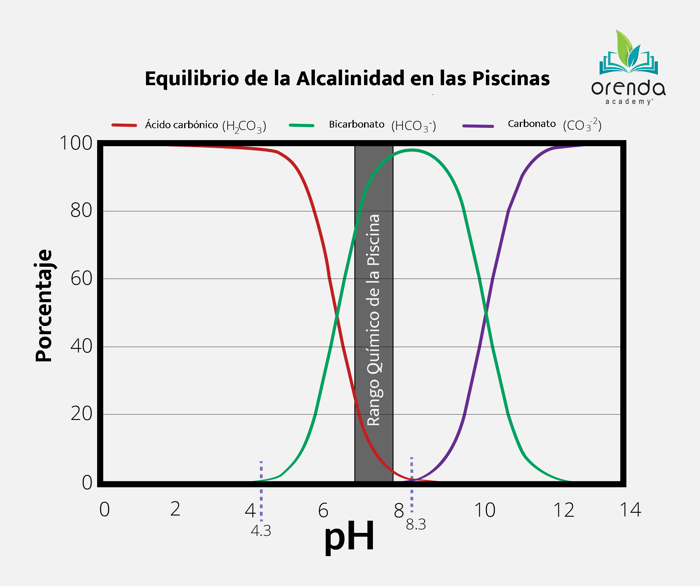
La línea púrpura muestra los iones de carbonato, que comienzan a aparecer a un pH de 8.3, cuando los iones de bicarbonato comienzan a convertirse.
Como puede ver en la tabla, en el rango de pH de la química de la piscina, la gran mayoría de la alcalinidad es bicarbonato. Los iones de carbonato comienzan a formarse únicamente si su pH excede 8.3. Esto explica por qué es mucho más difícil mantener el calcio en solución con un pH superior a 8.3: los iones de carbonato son muy atraídos por el calcio, por lo que crean carbonato de calcio y se precipitan fuera de la solución:
Ca ++ + CO3 - ⇌ CaCO3
Calcio + ion carbonato ⇌ Carbonato de calcio
Piense en el polvo de yeso, las incrustaciones de carbonato en las celdas de sal o el carbonato de sodio que causa el agua turbia de la piscina. Todas estas condiciones ocurrieron debido a violaciones del ISL. El polvo de yeso o del recubrimiento tiene hidróxido de calcio de pH 12.6 qué fuerza la formación de iones de carbonato; las células de sal producen un subproducto de hidróxido de sodio de pH 13.5, que promueve la formación de iones de carbonato; y la propia ceniza de soda es carbonato de sodio con un pH de 11.6. Los tres precipitan carbonato de calcio gracias a la reacción anterior.
Relacionado: Equilibrio del ISL y manejo del calcio (Pilar 1)
Cómo calcular la alcalinidad corregida y de carbonato
Ecuación de alcalinidad corregida
Para calcular la alcalinidad corregida, simplemente reste la alcalinidad del isocianurato (y el borato, si corresponde) de la alcalinidad total1. La alcalinidad del isocianurato se puede calcular restando aproximadamente un tercio de sus ppm de CYA de las ppm de AT. Si desea ser más preciso, el factor de corrección exacto depende del pH. Cuanto menor sea su pH, menor será el factor de corrección. Consulte la tabla ISL a continuación:
-1.png?width=702&name=ISL%20Equivalents%20chart%20(espanol)-1.png)
Observemos un ejemplo. Digamos que tiene 7.8 de pH, 100 ppm de alcalinidad total y 60 ppm de CYA:
Alcalinidad corregida (AC) = Alcalinidad total (AT) - (CYA x [factor de corrección al pH])
CA = 100 - (60 x [factor de corrección a 7,8 pH])
CA = 100 - (60 x [0,35])
CA = 100 - (21)
CA = 79 ppm
Como puede ver, aumentar el CYA aumenta la corrección2, lo que significa que reduce la alcalinidad corregida. Para reiterar: un CYA más alto significa un ISL más bajo. Esta es una de las razones por las que un CYA mínimo es nuestro cuarto pilar de cuidado proactivo de la piscina. Por supuesto, si su piscina no usa CYA, la alcalinidad total debe ser completamente carbonato (con muy pocas excepciones). Por tanto, en una piscina no estabilizada, no es necesario hacer este cálculo.
Concentración de iones de carbonato
La concentración de iones carbonato es más fácil si se expresa en partes por millón de CO3- o como carbonato de calcio (CaCO3). Sí, asi es. Aparentemente, algunos químicos decidieron hacer el tema más confuso. De cualquier manera, la fórmula es la siguiente:
Alcalinidad de carbonatos (CaCO3 mg/L) = 100.000 [K2 (HCO3 -) (10 pH)]
Y si realmente desea convertir la alcalinidad de carbonatos de unidades de CaCO3 a unidades de CO32- , esta fuente tiene la respuesta. No queríamos profundizar en este aspecto. Pero quizás ya lo hayamos hecho.
Sistema amortiguación de alcalinidad
Es muy común que nuestros clientes nos pregunten acerca de la diferencia del pH y la alcalinidad total, ya que sus valores deben ser analizados semana tras semana. Están relacionados porque la alcalinidad amortigua los cambios en el pH; específicamente la disminución del pH repentina. Esto significa que todos los tipos de alcalinidad que hemos presentado pueden recibir o dar un ión de hidrógeno (disociación en ambas direcciones). Esta es la formula de disociacion:
CO2 + H2O ⇌ H2CO3 ⇌ HCO3- + H+ ⇌ CO3- + 2H+
Dióxido de carbono + agua ⇌ Ácido carbónico ⇌ Alcalinidad de bicarbonato + Hidrógeno ⇌ Alcalinidad de carbonato + 2 Hidrógeno
El bicarbonato y el carbonato se componen a raíz del CO2
 Tomando en cuenta que la alcalinidad puede dar y recibir hidrógeno, esto reduce la velocidad del cambio de pH. Sabemos que la cantidad de CO2 en su agua determina el pH , gracias a la física. Cuanto más CO2 exista, menor es el pH y viceversa. Por lo tanto, es posible que se pregunte por qué el ácido muriático (HCl) reduce el pH y la alcalinidad, ya que este no contiene CO2. La respuesta es muy sencilla: el ácido agrega hidrógeno, lo que invierte las disociaciones mostradas en los equilibrios anteriores. Los iones de bicarbonato y carbonato contienen CO2 y el ácido los convierte en ácido carbónico, lo que reduce el pH. Por eso la alcalinidad también se reduce con el ácido: en realidad se pierde. Si observamos el gráfico de arriba, podemos analizar lo que sucede cuando se mueve hacia la izquierda a lo largo del eje X o el valor del pH.
Tomando en cuenta que la alcalinidad puede dar y recibir hidrógeno, esto reduce la velocidad del cambio de pH. Sabemos que la cantidad de CO2 en su agua determina el pH , gracias a la física. Cuanto más CO2 exista, menor es el pH y viceversa. Por lo tanto, es posible que se pregunte por qué el ácido muriático (HCl) reduce el pH y la alcalinidad, ya que este no contiene CO2. La respuesta es muy sencilla: el ácido agrega hidrógeno, lo que invierte las disociaciones mostradas en los equilibrios anteriores. Los iones de bicarbonato y carbonato contienen CO2 y el ácido los convierte en ácido carbónico, lo que reduce el pH. Por eso la alcalinidad también se reduce con el ácido: en realidad se pierde. Si observamos el gráfico de arriba, podemos analizar lo que sucede cuando se mueve hacia la izquierda a lo largo del eje X o el valor del pH.
Si desea evitar la reducción de la alcalinidad, es común que se inyecte dióxido de carbono en el agua.
La alcalinidad del cianurato, en todas sus formas ([H3 Cy], [H2 Cy–], [HCy2–], [Cy3–]), no contiene dióxido de carbono. t Ni tampoco el borato3. Por lo tanto, deben eliminarse (corregirse) de la alcalinidad total para que el ISL tenga el valor correcto de cuanta alcalinidad de carbonato/bicarbonato hay en el agua. Pero de nuevo, si no tiene CYA o borato en su piscina, no necesita esta corrección de alcalinidad. La fórmula del ISL utilizaría su lectura de alcalinidad total.
Conclusión
Estamos conscientes de que este es un tema denso y esperamos haber podido ayudar con la confusión. Pero seamos honestos... es bastante complicado. El objetivo del artículo fue distinguir entre los iones de carbonato en sí mismos y el sistema de alcalinidad de carbonato (al cual conoceremos como alcalinidad corregida). La razón por la que es importante conocer la alcalinidad corregida es porque otros factores que contribuyen a la alcalinidad total (como la alcalinidad del cianurato y el borato) que no contienen dióxido de carbono y que por lo tanto no contribuyen o deberían de contribuir al valor del ISL.
Entonces, cuando hablamos de la saturación de carbonato de calcio, o lo que mide el ISL, debemos también considerar esos otros tipos de alcalinidades y eliminarlos de la ecuación. Si desea obtener más información, le recomendamos que investigue más del tema. Puede continuar con los siguientes artículos de alta relevancia aquí, aquí y aquí. Si tiene preguntas para nosotros, por favor comente en la sección de abajo.
1 El borato es otro sistema de amortiguación de pH que también se puede restar de la alcalinidad total, si se usa. Dicho esto, el impacto del ISL es mínimo y, por lo tanto, no se incluye en la calculadora de la aplicación Orenda.
2 Este documento técnico de John Wojtowicz se encuentra entre los mejores recursos que existen sobre este tema. Si está buscando información sobre el ácido cianúrico y cómo amortigua el pH, este artículo lo tiene todo. Fue nuestra fuente principal para este artículo.
3 Wojtowicz, John A. 1993. El efecto del ácido cianúrico y otras interferencias en la medición de la alcalinidad de carbonatos. Página 60.
