Que causa alta alcalinidad en la piscina

Alguna vez le ha tocado lidiar con una piscina en donde la alcalinidad cambia o fluctua constantemente. En general, la alcalinidad suele bajar semana tras semana gracias al uso del ácido, pero qué tal cuando la alcalinidad se sube? Si usted tiene alimentadores de CO2, este artículo puede ayudarle específicamente a entender la química y los procesos y el porque su alcalinidad tiende a subir. Como siempre, es un placer poder atender sus dudas, si tiene cualquier pregunta no dude en contactarnos.
En este articulo:
- Que es la alcalinidad?
- Cómo elevar la alcalinidad en la piscina
- Porque los sistemas de CO2 elevan la alcalinidad
- Subproductos de hipoclorito
- Compuestos de nitrógeno
- Conclusión
Que es la Alcalinidad?
Ya hemos escrito acerca de la alcalinidad varias veces pero si se confunde con los conceptos, puede utilizar los siguientes artículos como referencia.
La alcalinidad total (AT) es la suma de todas las sustancias alcalinas en el agua; específicamente, aquellas sustancias que pueden aceptar iones de hidrógeno (H+). Lo cual funciona como mecanismo de resistencia a la caída repentina del pH. En otras palabras, la alcalinidad funciona como "amortiguación". Lo contrario a la alcalinidad es la acidez, pero no aplica mucho en el negocio de piscinas.
Gracias a la química del agua, una de las alcalinidades más influenciables es la alcalinidad de carbonato. En el pH normal de una piscina, la alcalinidad de carbonato más común es el ion de bicarbonato (HCO3-); por si se lo preguntaba, el mismo de tipo de bicarbonato encontrado en el bicarbonato de sodio, es por eso que este compuesto se usa para elevar la alcalinidad en una piscina, como lo describimos en este procedimiento.
El resto de la alcalinidad en la piscina se compone de otras sustancias que también ayudan como sistema de amortiguación. Entre estas, se encuentra el acido isocianurico, el cual recomendamos mantener al mínimo. Este crea o incrementa la alcalinidad de cianurato. Los boratos también tienen a contribuir a la alcalinidad total, aunque son menos significantes que el CYA. La alcalinidad también incluye hidróxidos (OH-), los cuales contribuyen de manera mínima, pero como lo descubrirá en este artículo, de poco a poco un poquito se hace mucho.
Alcalinidad de carbonato o "alcalinidad corregida"
Cuando decimos "alcalinidad de carbonato", nos referimos a cualquier alcalinidad que incluya dióxido de carbono, como se muestra en la tabla a continuación. Esta tabla excluye otros tipos de alcalinidad que contribuyen a la alcalinidad total (TA), como la alcalinidad del cianurato y de borato. Esta exclusión también se conoce como "corrección" de alcalinidad, la cual es necesaria a la hora de calcular el valor numérico del ISL.
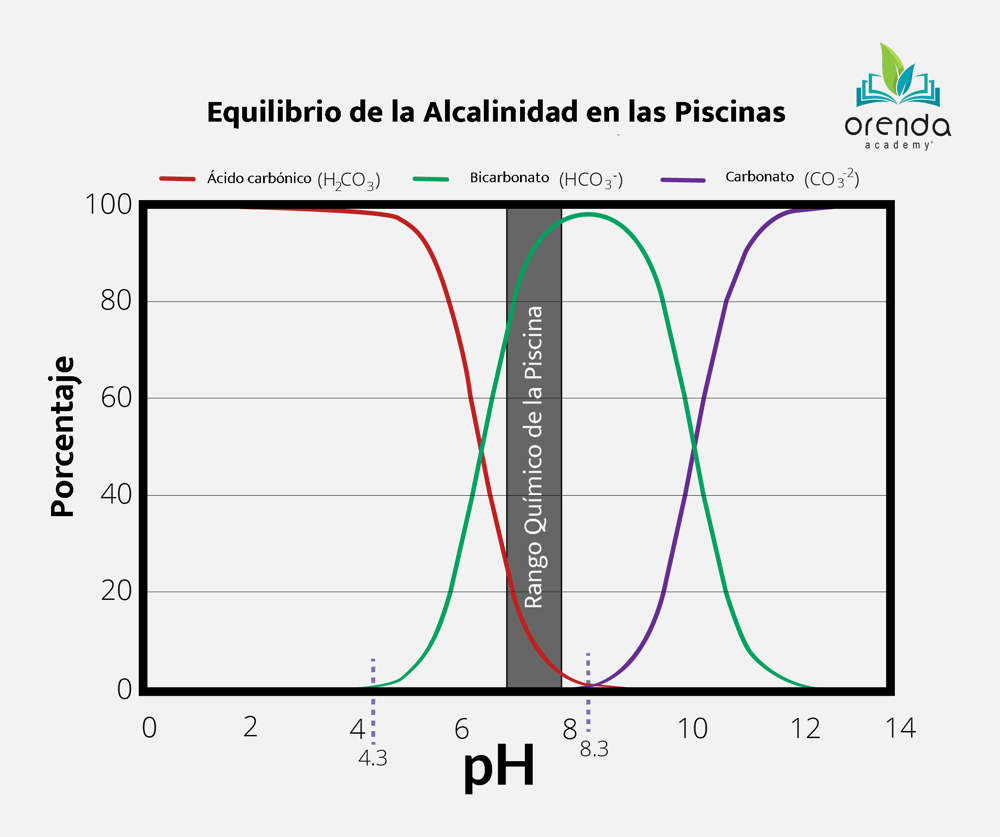
Cuando el dióxido de carbono se disuelve en el agua, se mantiene en equilibrio con el ácido carbónico (H2CO3), el cual es ilustrado por la línea roja. Cuando el pH baja por debajo de un nivel de 4.3, la concentración es completamente ácido carbónico. El dióxido de carbono interactúa con los compuestos químicos en diferentes maneras dependiendo del pH, por eso se le conoce como alcalinidad de carbonato. A medida que aumenta el pH, el ácido carbónico se disocia y se convierte en bicarbonato (HCO3-) y en un ion hidrógeno libre (H+). Un aumento adicional del pH por encima de aproximadamente 8.3 hace que el bicarbonato se disocie de nuevo y se convierta en carbonato (CO32-) al perder otro ión de hidrógeno, y lo que empezó como ácido carbónico ahora es carbonato y dos iones de hidrógeno libres. Esto suena confuso pero explicaremos las reacciones químicas más a fondo en este artículo.
Ahora que ya hicimos un poco de introducción, es hora de ir directo al grano: que causa una incremento en la alcalinidad de la piscina? Pues primeramente, el técnico de mantenimiento de manera intencional.
Como subir la alcalinidad
Incrementar la alcalinidad es tan sencillo como solo agregar bicarbonato al agua. El producto más seguro, rentable y popular es el bicarbonato de sodio. El bicarbonato de sodio es excelente para aumentar la alcalinidad y también es conveniente porque solo eleva el pH ligeramente ya que su pH es solo de aproximadamente 8.3. Si observamos de nuevo la gráfica de la alcalinidad se dará cuenta que la mayor parte de la alcalinidad en la química de la piscina es de bicarbonato. El otro producto para aumentar la alcalinidad es el carbonato de sodio (también conocido como ceniza de soda), pero debido a que su pH es mucho mayor, tiende a tener una mayor influencia en el incremento del pH lo cual puede nublar su piscina. La ceniza de soda tiene un pH de 11.3 (en una solución al 1%), es 1000 veces más básica que el bicarbonato.
Como todo químico, existe un proceso a seguir, en este procedimiento describimos cómo agregar ceniza de soda o bicarbonato de sodio a su piscina.
Para aumentar la alcalinidad con bicarbonato de sodio, puede calcular su dosis utilizando una tabla de dosificación o la aplicación de Orenda (disponible en App Store y GooglePlay 100% gratis). Una vez que sepa la cantidad de bicarbonato de sodio necesaria, disuélva previamente en un balde de agua y agregue lentamente alrededor del perímetro de la piscina. Este es el video del procedimiento:
Y aunque el bicarbonato de sodio es la forma más común de aumentar la alcalinidad, en las piscinas con alimentadores de CO2 la alcalinidad tiende a aumentar por sí sola.
Los sistemas de alimentación de CO2 aumentan la alcalinidad?

Las piscinas que usan equipos de alimentación de CO2 tienden a mostrar un incremento en su alcalinidad. Para explicar este fenómeno, primero queremos compartir esta presentación de Richard Falk. Técnicamente hablando, la inyección de CO2 no afecta directamente la alcalinidad. Pero cualquier persona que tenga una piscina con un sistema de CO2 sabe por experiencia que la alcalinidad aumenta poco a poco sin tener que agregar carbonato de sodio o bicarbonato. Es un hecho.
Para explicar el porque, observemos una vez más el gráfico de alcalinidad. Vale la pena preguntarse a sí mismo: cómo es que el CO2 baja el pH primero que nada? Hablamos al respecto en nuestro artículo acerca del CO2 y la ley de Henry, pero hagamos un breve resumen. Entre más CO2 se disuelva en el agua, lo más bajo que será el pH y viceversa. Entonces al inyectar CO2 en el agua, se baja el pH ya que la mayor parte se convierte en ácido carbónico, y el ácido carbónico reduce el nivel del pH en el agua. Simple y sencillo.
Por un buen tiempo, asumimos que la alcalinidad aumentaba con el tiempo ya que ese ácido carbónico adicional tenía la tendencia a disociarse eventualmente para convertirse en bicarbonato. Es cierto, excepto que en la gráfica de alcalinidad de arriba solo se nos muestra parte del equilibrio... los carbonatos. El gráfico no muestra qué pasa con los iones de hidrógeno. Esta reacción muestra el equilibrio:
CO2 + H2O ⇌ H2CO3 ⇌ HCO3- + H+ ⇌ CO3-- + 2H+
dióxido de carbono + agua ⇌ ácido carbónico ⇌ bicarbonato + hidrógeno ⇌ carbonato + 2 hidrógenos
Estos iones de hidrógeno libres (H+) son muy importantes! Contrarrestan perfectamente el bicarbonato adicional creado al inyectar CO2 , por lo que en el punto de vista de la alcalinidad, todo está en equilibrio. Así que nuestra teoría inicial, en el mejor de los casos, es una verdad a medias. 1 Gracias a nuestro amigo químico y mentor Richard Falk, ahora entendemos exactamente por qué aumenta la alcalinidad en las piscinas de CO2 . Y sucede por las siguientes dos razones.
Subproductos de hipoclorito
La alcalinidad aumenta debido al exceso de hidróxido en los tipos de cloro que son de hipoclorito. Y en el caso del hipoclorito de calcio (hipo cal), no solo hay exceso de hidróxido, también hay exceso de carbonato.2 Este exceso de hidróxido (y en el caso del hipo cal, el exceso de carbonato) contribuye a la alcalinidad y, por tanto, la alcalinidad aumenta. Sin embargo, esto es solo un ligero aumento en la alcalinidad porque cuando el cloro se oxida o desinfecta, el HOCl (la forma fuerte y mortal del cloro, ácido hipocloroso) se convierte en HCl (ácido clorhídrico, también conocido como ácido muriático) y reduce el pH y la alcalinidad en su mayor parte. De cualquier manera, esto sigue siendo un aumento neto de alcalinidad sin tener que agregar bicarbonato de sodio ni nada más.
Además, estos hidróxidos aumentan el TA en piscinas que usan ácido y bicarbonato de sodio para el control del pH y la alcalinidad, pero un poco de ácido adicional lo cancela, por lo que nadie se da cuenta.
Compuestos de nitrógeno
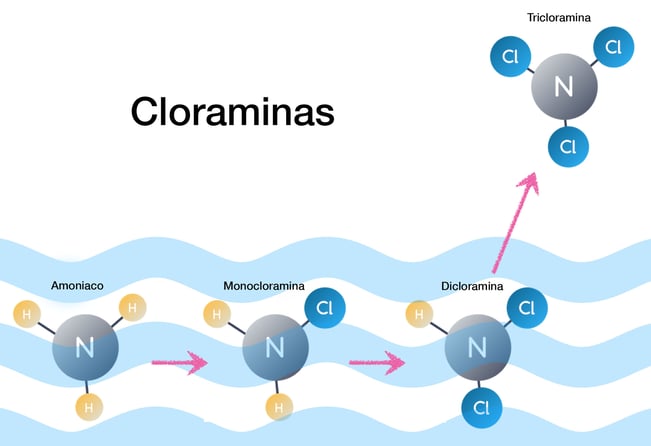
Acerca del punto anterior sobre los hidróxidos del hipoclorito de cloro, la alcalinidad puede aumentar más rápidamente si la oxidación del cloro no completa el proceso. La oxidación incompleta implica menos ácido hipocloroso, HCl, creado para bajar el pH y la alcalinidad. Esto puede ocurrir cuando el cloro se combina con compuestos nitrogenados como urea y amoníaco.3 A esto se le conoce como cloro combinado en la industria de piscinas.
Si le gustaria leer mas al respecto puede continuar con el siguiente articulo: Comprensión del punto de ruptura de cloración.
Conclusión
Solíamos pensar que el inevitable aumento de la alcalinidad en las piscinas con alimentadores de CO2 se debía a la introducción de ácido carbónico adicional, que finalmente se convertía en más bicarbonato que el agua. Esta teoría no solo tenía sentido para nosotros, sino que también tenía sentido para todas las personas con las que discutimos la gráfica de alcalinidad. Eso es hasta que le preguntamos a un químico real. Resulta que la alcalinidad aumenta debido al exceso de hidróxidos que dejan los cloro de hipoclorito: hipoclorito de sodio (cloro líquido) e hipoclorito de calcio (hipo cal).
Hay un aumento total menor cuando cuando todas las cosas están completamente oxidadas en el agua. Pero hay un aumento más rápido en la alcalinidad total cuando el cloro no está oxidando completamente las cosas y, en cambio, se combina con compuestos de nitrógeno como la urea y el amoníaco. Esto cancela la producción de ácido clorhídrico (HCl) lo cual reduciría el pH y la alcalinidad. En cambio si no se produce este ácido porque el cloro está ocupado oxidando, la alcalinidad sube y sube.
Este es un tema bastante denso y complicado, si tiene cualquier duda por favor no dude en contactarnos, nuestra asesoría es completamente gratis y siempre lo será. También siempre puede dejar un comentario en la sección de abajo.
1 Esto es algo frustrante ya que nuestra teoría tenía mucho sentido. Sin embargo, con el gráfico solo se muestra la alcalinidad y se excluye deliberadamente los iones de hidrógeno. Es por eso que nos aseguramos de verificar toda la información que compartimos en Orenda. Es importante siempre estar proporcionar información 100% verídica.
2 el cal hipo de 68% crea cloro libre (HOCl ⇌ OCl -) pero deja subproductos. Entonces el 68% del producto se convierte en cloro, y el otro 32% típicamente consiste de 18% de sal de cloruro, 1.5% de clorato de calcio (Ca (ClO3)2), 0.5% de cloruro de calcio (CaCl2), 1.0% de hidróxido de calcio. (Ca(OH)2), 2,5% de carbonato de calcio (CaCO3) , y 8.5% de agua (H2O). Fuente: Richard Falk y ScienceDirect.
3 Gracias de nuevo a Richard Falk por explicarnos esta química. Para evitar confusión y hacer las cosas más fáciles, no incluimos toda la química involucrada en esto, pero es posible que algún día publiquemos un PDF con todas las ecuaciones. Para nosotros, tiene sentido, ya que las piscinas más usadas parecen tener una tasa de incremento de alcalinidad mayor que las piscinas poco usadas. Esto se debe gracias a la producción de las cloraminas y por qué es tan importante controlarlas.
