Otros Tipos de Ácido Para la Piscina

El ácido muriático es el más popular en el negocio de las piscinas para reducir el pH y la alcalinidad, especialmente en Estados Unidos. Sin embargo existen otras opciones y debido a la escasez del cloro del 2021, lo cual ocasionó una escasez de ácido muriático, es conveniente conocer esas opciones y cómo se usan. En este artículo hablamos del CO2 para disminuir el pH en la piscina, y del ácido sulfúrico y el bisulfato de sodio para disminuir el pH y la alcalinidad en la piscina o alberca dependiendo de las circunstancias.
También puede escuchar el siguiente podcast al respecto (está en inglés):
En este articulo:
- Tabla de dosificación de los diferentes ácidos
- Porque es necesario el ácido en las piscinas o albercas
- Dióxido de carbono (CO2)
- Ácido Sulfúrico
- Diferencias entre el ácido muriático y el sulfúrico
- ácido sulfúrico y cloruro de calcio
- Bisulfato de Sodio
- Diferencias entre el ácido muriático y el bisulfato de sodio
- Sulfatos
- Como eliminar o reducir los sulfatos de la piscina o alberca
- Quimicos para piscina para el arranque o llenado inicial
- Conclusión
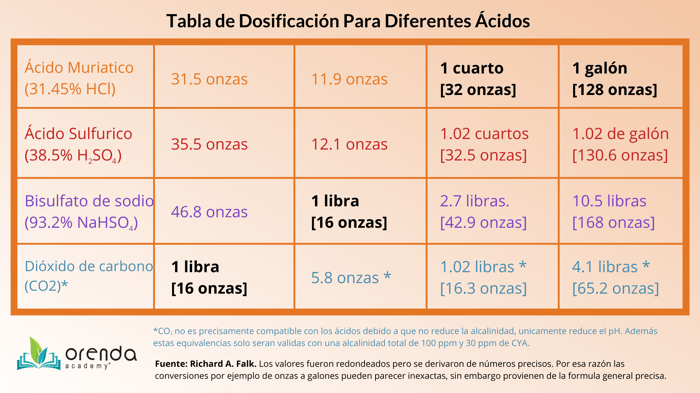
Porque se usa el ácido en las piscinas?
El ácido se ha establecido como el químico principal para reducir el pH y reducir la alcalinidad cuando es necesario para establecer un equilibrio en el agua. Este tiene una alta concentración de iones de hidrógeno (H+) al disociarse en el agua. Cuando esto sucede, los iones de bicarbonato (HCO3-) junto con los iones de carbonato (CO32-) se convierten en ácido carbónico (H2CO3), o simplemente la forma acuosa del CO2(aq), lo cual reduce el pH. La tabla a continuación muestra el proceso y su dependencia en el pH de la piscina:
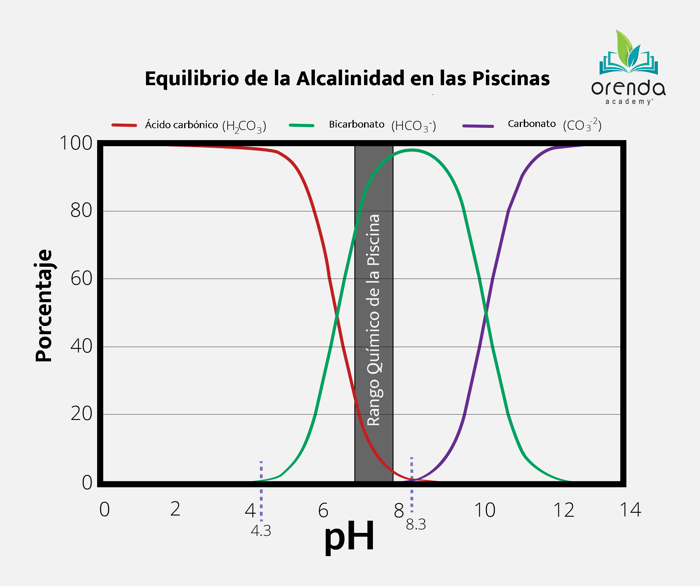
Sin el acido, el pH siguiendo las leyes de física, tenderá a subir llegando hasta el valor de 8.0 en la mayoría de las piscinas o albercas. Este efecto dificulta de manera significativa el equilibrio del ISL, especialmente durante el verano cuando el agua está aún más caliente. En piscinas sin CYA o estabilizador, un pH más alto significa un menor porcentaje de ácido hipocloroso (%HOCl), el componente principal que actúa como desinfectante en el cloro. Y con acido, como ya lo sabemos el cambio efectivo en el pH dependerá de la alcalinidad en su piscina.
Uno de los ácidos más populares es el acido muriatico. El acido muriatico es simplemente una forma diluida de acido hidrocloridrico (HCl) y generalmente su concentración es de 31.45% HCl. Sin importar que tipo de ácido utilice y su porcentaje y concentración, es crítico diluirlo en agua antes de agregarlo a la piscina, gracias a su densidad el ácido se hundirá hasta el fondo rápidamente y puede dañar las superficies. Desarrollamos este procedimiento para mostrarle cómo agregar ácido correctamente.
Además del ácido muriático, como ya lo mencionamos existen otras alternativas;
Dióxido de Carbono (CO2)

Dosis de comparacion: 1 libra o 16 onzas de CO2 es equivalente en cuestión de efecto en el agua a 32.8 onzas de ácido muriático con 31.45% de HCL. Lo cual significa que se necesitan 3.9 libras de dióxido de carbono para ajustar el pH de la misma manera que 1 galón de ácido muriático lo haría. Es importante recordar que el CO2 no afecta la alcalinidad.
El dióxido de carbono (CO2) es probablemente el mejor reductor de pH y el más inofensivo para el planeta. El CO2 se puede inyectar en el agua utilizando tanques a presión y un sistema de alimentación. Por eso mismo este sistema es más comun en piscinas comerciales. El dióxido de carbono tiene la capacidad de aumentar el pH al disolverse fácilmente en el agua para crear ácido carbónico(H2O + CO2→ H2CO3).A diferencia del ácido, el CO2 no reduce la alcalinidad ya que los iones de bicarbonato y carbonato en el agua no sufren cambios.De hecho, se ha observado que la alcalinidad tiende a aumentar en piscinas que usan sistemas de alimentación de CO2 por ciertas razones indirectas.
Siendo una libra de dióxido de carbono aproximadamente equivalente con un cuarto de galón de ácido muriático, esto lo hace una opción muy viable y accesible a la hora del mantenimiento y contención del pH en comparación con cualquier otro tipo de ácido. Sin embargo, sus costos dependen significativamente en qué tipo de sistema utiliza, si tiene que reemplazar el tanque cada vez que se le acabe... tal vez el CO2 no sea tan buena idea. Sin embargo las piscinas comerciales con sistemas de CO2 tienden a adaptar un sistema en donde los tanques son re-llenados con el gas cada vez que es necesario, esto termina siendo muy economico.
Acido Sulfurico (H2SO4)

Dosis de comparacion: en realidad el ácido muriático y el ácido sulfúrico son muy similares en cuestión de dosis dado que 1.02 onzas de ácido sulfúrico con un porcentaje del 38.5% es equivalente a 1.00 onza de HCl al 31.45%. Lo cual es tan solo un 2% extra en volumen para causar el mismo efecto en el pH y la alcalinidad de la piscina o alberca.
A pesar de tener un impacto muy similar en volúmenes cercanos, estos dos ácidos no son lo mismo. La principal diferencia entre ellos es el subproducto que se queda en el agua después de su uso. Mientras que el ácido muriático deja cloruros por detrás, los cuales no son de mucha importancia tomando en cuenta que todos los tipos de cloro dejan cloruros en el agua al usarse, el acido sulfurico deja como residuo sulfatos, los cuales causan problemas al acumularse en altas concentraciones con el tiempo. Hablaremos más al respecto en la sección de abajo.
Pero tiene que saber que un galón de ácido sulfúrico deja como residuo 47.1 ppm de sulfatos en una piscina de 10,000 galones de agua.
Diferencias entre el ácido sulfúrico y ácido muriático
Las principales diferencias son las concentraciones. Después de un poco de investigación1 descubrimos que el ácido muriático que es 31.45% HCl es técnicamente más fuerte que el ácido sulfúrico tomando en cuenta la concentración. La concentración más comun de ácido sulfúrico es de 38.5% pero la dosificación es básicamente la misma:
La dosis de ácido muriático del 31.45% x (1.02) = Dosis de ácido sulfúrico de 38.5%
Ejemplo:
32 onzas de ácido muriático = 32.64 onzas de ácido sulfúrico
Ácido sulfúrico y cloruro de calcio
Resulta que a diferencia del ácido muriático, no se debe de mezclar ácido sulfúrico con cloruro de calcio. Si alguna vez ha intentado disolver cloruro de calcio y ácido sulfúrico en una cubeta con agua, posiblemente se dio cuenta de que esto puede causar que el cloruro de calcio flote en la superficie y sea difícil de mezclar. Aún no sabemos porqué esto sucede pero la reacción se ve de la siguiente manera:

Bisulfato de Sodio (NaHSO4)

Dosis de comparación: 1 libra o 16 onzas de bisulfato de sodio con un 93.2% de concentración es equivalente a 12.1 onzas líquidas de 31.45% de HCl. Ya que el bisulfato de sodio es un químico seco, el calcular el peso y el volumen pueden ser algo confuso, siga las instrucciones de dosis en la etiqueta.
El bisulfato de sodio (sulfato de hidrogeno de sodio) también es conocido como "ácido seco" en la industria de las piscinas. Generalmente es necesario incorporar un sistema especializado para disolver el ácido en el agua, y luego alimentar la solución de ácido en circulación. Algunas piscinas comerciales usan marcas como AcidRite® y AcidPlus®. Pero de hecho este tipo de acido es más comun en piscinas o albercas residenciales y generalmente es fácil de conseguir en las tiendas de distribución. Se vende en forma de gránulo seco en cubetas. Una vez disuelto, se puede verter alrededor del perímetro de la piscina. Nunca agregue bisulfato de sodio sin disolver directamente en la piscina, y nunca deje que se asiente en la superficie de la piscina. Siempre procure pre-disolver en una cubeta de agua.
Mientras que este producto es ampliamente disponible en el mercado, no nos sorprendería si comenzara a escasear en los próximos meses futuros hasta que los problemas de la cadena de suministro se superen. En parte porque los productos necesarios para producir bisulfato de sodio incorporan ácido sulfurico:
NaCl + H2SO4 → HCl + NaHSO4
Salt + Acido sulfurico → Acido hidrocloridrico + Bisulfato de sodio
Diferencias entre el ácido muriático y bisulfato de sodio
El bisulfato de sodio se vende generalmente en un porcentaje del 93.2 para la industria de piscinas y apesar de que esto suena como un alto porcentaje, sigue siendo un ácido más débil en cuestión de volumen en comparación con el ácido muriático. Según onBalance y otras fuentes, 10.5 libras o 168 onzas de bisulfato de sodio son equivalentes a un galón o 128 onzas líquidas de ácido muriático. Así que por cada onza de ácido muriático, se necesitarian aproximadamente 1.31 onzas de bisulfato de sodio para generar el mismo efecto. Esto explica de cierta forma porque el bisulfato de sodio es más costoso a largo plazo. Puede usar el gráfico de arriba para identificar el contraste.
A pesar de que se implica una mayor inversión para su uso, el bisulfato de sodio es más fácil de manejar que los otros dos tipos de ácido. Sin embargo deja sulfatos y sodio como residuo lo cual aumenta más rápidamente el valor de sólidos disueltos totales, SDT.
Una libra de bisulfato de sodio deja como residuo 9.6 ppm de sulfato en 10,000 galones de agua. Comparando con el ácido sulfúrico esto significa:
En 10,000 galones de agua...
1.02 galones de ácido sulfúrico del 38.5% = 10.5 libras de bisulfato de sodio al 93.2%
[(1.02) x 47.1 ppm] en comparacion con [(10.5) x 9.6 ppm]
48 ppm de sulfatos como residuo cuando se usa ácido sulfúrico y 100.8 ppm cuando se usa la misma cantidad de bisulfato de sodio
Una dosis equivalente de bisulfato de sodio deja como residuo 100.8 ppm de sulfatos, en comparación con las 48 ppm de sulfatos que dejaría el ácido sulfúrico. Lo cual es más del doble de residuo de fosfatos (2.1) También podemos hacer la conversión de manera inversa para comparar el residuo con una libra de bisulfato de sodio:
En 10,000 galones de agua...
1 libra de bisulfato de sodio al 93.2% = 12.1 oz. de ácido sulfúrico al 38.5%
Lo cual deja como residuo 9.6 ppm de sulfatos en comparación con [47.1 ppm ÷ (128 ÷ 12.1)]
Lo cual indica
9.6 ppm en comparación con 4.45 ppm si se usa ácido sulfúrico
Una vez más sin importar la cantidad, el residuo al usar bisulfato de sodio es un poco más del doble (2.15). Así que es fácil concluir que al usar dosis equivalentes, el bisulfato de sodio deja 2.15 veces más sulfatos que al usar ácido sulfúrico. Esta es una de las razones por las cuales organizaciones como la PWTAG (o grupo asesor del tratamiento de agua para piscinas, del reino unido) no promueve el uso e incluso desalienta la implementación de bisulfato de sodio en la piscina. Citado desde su sitio de internet:
"Un valor alto de los sólidos disueltos totales (SDT) no necesariamente será un factor indicador de una sobresaturación de sulfato si se usa bisulfato de sodio en el agua de la piscina. La sobresaturación de sulfato ocurre en condiciones de agua balanceada, incluso en concentraciones por debajo de los niveles máximos recomendados , pero de manera más lenta debido a que la sobresaturación depende significativamente de la concentración.Hay que tener en cuenta también que los iones de sulfato pueden migrar a los morteros de cemento, revoques, soleras u hormigón y comenzar a crear reacciones químicas. Sin embargo, los efectos no serán inmediatamente evidentes ya que se manifiestan en la superficie de los morteros en contacto con el agua de la piscina. " [énfasis añadido]
Sulfatos
Pero entonces, queda claro que son los sulfatos y porque deberian de preocuparnos? Honestamente antes de realizar la investigación apropiada para redactar este articulo, no sabíamos exactamente qué eran los sulfatos y cómo nos afectan en el mundo de las piscinas. Sabíamos que causaban cierta corrosión y sarro al combinarse con el calcio pero resulta que según el grupo de asesor PWTAG, los sulfatos no deben de exceder los 300 mg/L (ppm y mg/L son unidades equivalentes) 2:
Cláusula general 7.3.2.1
Lo ideal es que la concentración de sulfato (SO4 2-) del agua de las piscinas no supere los 300 mg/L. Cuando no se puedan evitar niveles mayores a dichas concentraciones de sulfatos, se deben utilizar adhesivos impermeables y materiales de rejuntado que no se vean afectados por el sulfato. De lo contrario, los altos niveles de sulfato reaccionarían y erosionarían los materiales que contienen cemento Portland (CEM 1). - PWTAG [la cita original tenía SO3 en lugar de SO4 2- , que, según Richard Falk, es un error tipográfico].
El nivel de 300 ppm (o mg/L) es de hecho un valor muy bajo tomando en cuenta la cantidad de residuo que el ácido sulfúrico y el bisulfato de sodio dejan en el agua. Si usa estos ácidos frecuentemente para el mantenimiento de su piscina o alberca, la dilución constante es probablemente algo necesario.
Es importante saber que los sulfatos rara vez se introducen en el agua de forma natural y, de ser así, generalmente suelen ser pequeñas cantidades, como cuando se llena la piscina con agua de pozo. Normalmente, los sulfatos son introducidos por varios productos químicos. Obviamente ácido sulfúrico y bisulfato de sodio, pero también el monopersulfato de potasio que se usa como choque oxidante sin cloro y también el sulfato que proviene de algicidas a base de cobre.
Hablemos un poco más del efecto dañino que tiene el sulfato en los materiales de su piscina.
Ataque del concreto
Rápidamente buscando en internet el término 'ataque de sulfato al concreto' se muestra una gran cantidad de información indicando los efectos que tienen los sulfatos en los materiales cementosos como el yeso y el concreto en las piscinas. Resulta que es conocimiento comun en la industria del hormigón que los sulfatos destruyen estos materiales. Según Richard Falk, a nivel molecular, un ion sulfato (SO42-) es bastante similar a un ion carbonato (CO32-). Cuando los niveles de sulfato son lo suficientemente altos, el ion sulfato puede superar al carbonato como ion dominante en el compuesto de carbonato de calcio (CaCO3) y formar sulfato de calcio. Esto esencialmente destruye el hormigón incluso si el ISL esta equilibrado y el agua no se considera agresiva. Entre más alta sea la concentración de sulfatos, mas rapido sera el daño causado en las superficies 2 y 3.
Corrosión de metales por sulfato y cloruro
Ciertos estudios han demostrado una relación directa entre niveles altos de fosfato y alta corrosividad en el agua, incluso cuando el agua está balanceada en cuestión al valor del ISL o Ryznar. En particular, la corrosión de los metales se acelera cuando existen tanto cloruros (Cl-) como sulfatos en el agua. Según la EPA , los sulfatos son incluso más corrosivos con la existencia de cloruros en el agua:
" En algunos casos, parece ser que los cloruros son influenciados con la existencia de sulfatos en el agua. Los cloruros presentes en cantidades tan pequeñas como 0.3% pueden producir corrosión severa cuando existen sulfatos en el agua. Incluso concentraciones bastante bajas de cloruros pueden causar corrosión cuando se concentran por oclusión en capas superficiales". - EPA.gov 4
Puede encontrar más información acerca de la corrosión acelerada gracias a la existencia de sulfatos en el agua aquí. La mayoría de las veces, uno se imagina los componentes metálicos como las escaleras, canales o accesorios de iluminación, pero es importante también recordar los componentes en el sistema de circulación, como los intercambiadores de calor, cierta tuberia, desnatadoras y válvulas. Todos estos componentes sufrirán corrosión y daños si existen altas concentraciones de sulfatos en el agua.
Sarro de sulfato de calcio
Como lo mencionamos anteriormente en este artículo, cuando los sulfatos se acumulan en altos niveles en el agua, estos remplazarán los iones de carbonato para formar sulfato de calcio. Lo cual destruye los compuestos a base de carbonato de calcio en la piscina que al mismo tiempo forman parte de las paredes y de la junta en la cerámica o veneciano. Además cuando existe un exceso esto puede conducir a la formación de sarro. El sarro de sulfato de calcio ocurre de manera similar al sarro de carbonato, gracias a la sobresaturación del compuesto en sí. Este tipo de sarro es incluso más problemático debido a un par de razones, primero que nada el sulfato de calcio no se puede ablandar y disolver como lo hacemos en este procedimiento para el sarro de carbonato, desafortunadamente no se puede remover químicamente debido a su dureza y forma en cristal afilado como lo podemos observar en las siguientes fotos proporcionadas por onBalance:

El sarro de sulfato forma cristales endurecidos. Esta es una sección cortada de una loseta y yeso de una piscina que tuvo que repavimentarse. Desafortunadamente no existe una solución química para el problema. Foto cortesía de onBalance5.
La segunda razón por la cual este sarro es tan fastidioso, es que es muy afilado y tiende a cortar fácilmente, es difícil de observar cuando recién comienza a formarse:

Cómo reducir los sulfatos en la piscina
Desafortunadamente, el unico metodo conocido es drenar y diluir con agua fresca, así como con los altos niveles de CYA o TDS.
Quimicos para un Arranque de piscina
Antes de cerrar este articulo, es importante que hablemos acerca del arranque adecuado para piscinas. Todos los arranques generalmente involucran el uso de ácido de alguna manera, incluyendo el Arranque Orenda™, en el cual recomendamos el uso de ácido para mantener el ISL en equilibrio durante los primeros 30 días. Sin embargo, los arranques de piscina tradicionales utilizan cantidades mucho mayores de ácido. Por lo cual puede parecer buena idea el uso de ácido sulfúrico, nosotros NO los recomendamos.
Oficialmente recomendamos no usar ni acido sulfurico ni bisulfato de sodio para el arranque Orenda™. Únicamente el popular ácido muriático del 31.45 % HCl. Para qué complicar la química del agua aún más con ingredientes que pueden ser corrosivos para los materiales como los sulfatos?
Dicho esto, si después de 30 días necesita realizar un tratamiento con ácido para eliminar imperfecciones, el ácido sulfúrico podría funcionar... solo asegúrese de tomar en cuenta cierta dilución en el agua de la piscina o alberca después del proceso para reducir la concentración extra de sulfatos. No recomendamos el uso de bisulfato de sodio o ácido sulfúrico para realizar un arranque en caliente, un lavado con ácido u otro tratamiento de bajo pH. Los sulfatos pueden ser contraproducentes, es siempre mejor utilizar el conocido ácido muriático en estos casos.
Conclusión
Si está teniendo dificultad para conseguir ácido muriático, la siguiente mejor alternativa para el control del pH y la alcalinidad dependerá de sus intereses y opciones disponibles. Para la reducción del pH, el CO2 siempre sera la opcion mas economica y segura para el medio ambiente, excepto por los costos iniciales de instalación del sistema de alimentación. Además, el CO2 solo reduce el pH, no la alcalinidad. Lo cual nos orilla al uso del ácido para controlarla, aunque no fluctúa tan frecuentemente puede usar nuestro gráfico de equivalencias con confianza si es necesario.
Siempre y cuando que esté dosificando correctamente, midiendo los químicos y diluyendo previamente antes de agregar a la piscina, no deberá tener problemas en grandes rasgos a la hora de reducir el pH y la alcalinidad. Pero recuerde que si usa ácido sulfúrico o bisulfato de sodio, estos dejaran sulfatos en la piscina como residuo y es crítico mantener sus niveles por debajo de las 300 ppm debido a que la corrosión de los metales y el deterioro del cemento y superficies aun ocurrirán pero a una velocidad mucho menor. Ademas, a niveles extremos por arriba de las 300 ppm, la formación de sulfato de calcio es inevitable. El sulfato de calcio no puede ser eliminado químicamente y la mayoría de las veces implica una remodelación completa del acabado, lo cual es altamente costoso.
Buena suerte durante esta escasez del cloro, esperamos que este articulo le sea valioso.
1 Realizamos una extensa investigación para poder desarrollar los artículos de la manera más completa posible, si identifica algún error por favor contactenos y lo corregiremos de inmediato. Es de nuestro mejor interés simplificar la información para el lector comun promedio.
2 Pool Water Treatment Advisory Group (PWTAG) es una autoridad en química del agua en el Reino Unido. Esta es su publicacion original acerca de los sulfatos en el agua: https://www.pwtag.org/sulphate-attack-february-2011/
3 Bensted, Rbrough y Page, et.al. Ataque de sulfato. Tema en ScienceDirect.com, originalmente de Durability of Concrete and Cement Composites. 2007.
4 Informe sobre la corrosión de determinadas aleaciones. Julio de 2001. Oficina de Prevención, Plaguicidas y Sustancias Tóxicas de la EPA.
5 Sarro de sulfato de calcio: CaSO4 · 2H2O. Aquí hay un estudio de caso de Que Hales de onBalance tratando de eliminarlo de una piscina en Arizona: https://aquamagazine.com/service/the-mystery-of-the -cristales-puntiagudos.html
