Qué es el peso molecular? El mol
_English_v1_00139_00139.jpg)
En este artículo navegaremos un poco más profundo en la ciencia de la química, específicamente el significado del mol en reacciones químicas y productos.
En este articulo:
- Que es la química molar?
- Usando moles para calcular los porcentajes de los productos químicos
- Conclusión
Qué es un mol?
Debido a que las moleculas y atomos son imprácticamente pequeños, existía la necesidad de compilar una cierta cantidad finita de estos elementos o compuestos, de ahi nacio el mol.
El mol se deriva a raíz del número de avogadro, el cual representa exactamente 6.02214076 × 1023 moléculas, elementos, iones o la unidad en cuestión. Aunque parezca un número arbitrario, el número de avogadro es la cantidad precisa de átomos en 12 gramos de carbón. 1
%20-%20Spanish.jpg?width=800&height=450&name=Molecular%20weight%20(g_mol)%20-%20Spanish.jpg)
El mol es necesario por que cierra la brecha entre el actual peso molecular, el cual es demasiado pequeño para ser medido, y la unidad de peso que puede ser medida prácticamente. Convierte una unidad teorética en una unidad real que puede ser utilizada en el laboratorio, pruebas, reacciones químicas, y diferentes industrias.
Por ejemplo, si quisiéramos combinar dos átomos de hidrógeno y uno de oxígeno para crear agua (H2O), cómo podríamos capturar cada partícula individualmente para el proceso? Por lo general se requiere una basta cantidad de cada elemento, la cual se puede medir por moles (g/mol), y por cierto sintetizar agua en el laboratorio requiere una gran cantidad de energía y recursos por lo cual no es muy viable hoy en dia.
Afortunadamente, los pesos moleculares de casi todas las sustancias conocidas han sido descubiertos y son de indole publico.
Como se calcula el mol
Mol = masa ÷ peso molecular
El objetivo de la fórmula anterior es determinar el número de moles de cierta sustancia y la relación es simple aritmética, dividir la masa total entre el peso molecular (g/mol), y este peso se puede encontrar en la tabla periódica.

El peso molecular se deriva del promedio de las masas atómicas de la molécula que existe en la naturaleza de manera estable. El peso molecular de todos los elementos puede encontrarse en la tabla periódica. Por ejemplo el cloro elemental tiene un peso de 35.45 g/mol. La realidad es que la mayoría de las sustancias en el mundo, son compuestos de varios elementos y no se encuentran de manera elemental.
Gracias al concepto del mol, con simples matemáticas podemos obtener el peso molar de cualquier compuesto.
Relación entre mol y peso molecular
El peso molecular de una sustancia es simplemente la suma de todos los pesos moleculares de los átomos en la molécula. Se expresa convencionalmente en unidades de masa atómica o gramos por mol. Al saber el peso molecular de la sustancia, podemos determinar el numero de moles presentes.
Por ejemplo, analicemos el peso molecular de la molécula del agua (H2O):
[Hidrogeno (1.0078 g/mol) x 2] + [Oxigeno (15.999 g/mol)] = H2O (? g/mol)
[2.0156 g/mol] + [15.999 g/mol] = H2O (18.015 g/mol)
Digamos que tenemos 10 gramos de agua liquida pura (H2O), y queremos saber la cantidad de moles en ese volumen. Dividiendo 10g por 18.015 g/mol obtenemos aproximadamente 0.56 moles de agua.2
Usando el mol para calcular los porcentajes en los productos químicos

Los moles son de hecho lo que se usa para determinar el porcentaje correspondiente de cada uno de los ingredientes utilizados en un producto químico.
Esto es directamente aplicable a los productos químicos utilizados en nuestra industria de piscinas.
Muchos de los químicos que utilizamos en la piscina son de hecho bastante complejos molecularmente hablando. El ingrediente activo podría ser un compuesto químico reconocido y enlistado, pero frecuentemente conlleva otras sustancias también. Por ejemplo los productos de tricloro (Tricloro-s-triazintriona) son usualmente atribuidos con un 99% de concentración, aunque también se encuentra disponible con porcentajes como del 53.5%. Pero que significa esto?
Hablaremos mas en detalle acerca de los porcentajes quimicos en nuestro siguiente articulo, por ahora centraremos nuestro enfoque en el peso molecular de los químicos mas populares utilizados en una piscina.
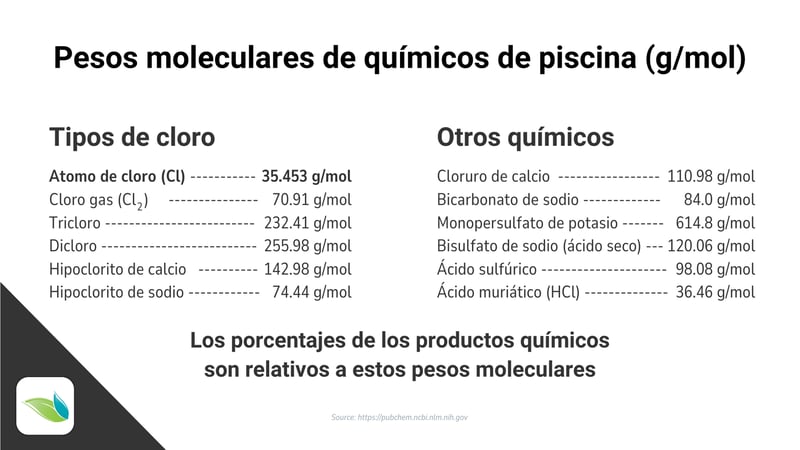
Tal como lo dice en esta ilustración, los porcentajes de los productos químicos son relativos a estos pesos moleculares. Esto significa que los porcentajes que se muestran en las etiquetas de los productos químicos son derivados del peso molecular del ingrediente activo en relación con el peso molecular de las sustancias con las que se deriva el producto.
Por si aun no es claro, el peso molecular del cloro puro como lo mencionamos anteriormente es de 35.453 g/mol, pero los diferentes productos clorinadores utilizados reflejan diferentes porcentajes. Pongamos por ejemplo el tricloro:
El tricloro tiene una masa molecular de 232.41 g/mol y aunque el producto es generalmente etiquetado como 99% Trichloro-s-triazinetrione, esto NO significa que el producto tiene 99% cloro disponible. Significa simplemente que la sustancia es 99% tricloro. Con las siguientes matemáticas podemos derivar el porcentaje de cloro real. Comparemos los pesos moleculares de ambas sustancias:
Cloro (Cl) = 35.453 g/mol
Tricloro (C3Cl3N3O3) = 232.41 g/molTenemos tres (3) átomos de cloro unidos en el CYA, lo que significa que de esta molécula el siguiente peso es correspondiente al cloro en si:
3 x (35.453) = 106.359 g/mol
Luego al dividir esa proporción por el peso total del compuesto podemos obtener el porcentaje real aparente:
106.359 ÷ (232.41) = 0.458 = 45.8% de cloro disponible en tricloro (por peso)
PERO debido a que el cloro en la forma de (Cl2) es lo que reacciona en el agua para crear el ácido hipocloroso, o la sustancia encargada de la desinfección y oxidación, (Cl2 + H2O → HOCl + HCl), tenemos que factorizar ese aspecto y multiplicar el 106.359 g/mol x 2, y después realizar la división total.
[2 x (106.359)] ÷ 232.41 = % de cloro disponible para ser utilizado
212.718 ÷ 232.41 = 0.915 = 91.5% de cloro total disponiblePero recordemos que el 99% significa 99% tricloro (mas 1% de sustancias no siempre identificadas), entonces al multiplicar el 91.5% por 99% obtenemos que en realidad existe un 90.6% de cloro disponible en los productos de tricloro, tal como se mostraba en la etiqueta ilustrada.
Conclusión
El mol es el puente que permite utilizar el peso molecular de las sustancias de manera practica. Nos permite compilar una cantidad definida de materia para poder manipularla y medirla. Gracias a los científicos y químicos de los últimos siglos sabemos prácticamente el peso molecular de todos los elementos descubiertos, y estos son listados en la tabla periódica.
Los pesos moleculares son expresados en gramos por mol (g/mol) y un mol es un numero que representa 6.02214076 x 1023, o 602,214,076,000,000,000,000,000 unidades, atomos o moleculas de una sustancia o compuesto. Lo podemos por esa razón medir en gramos. De ahi en mas, utilizaremos este concepto para calcular los porcentajes químicos a mayor detalle en nuestro siguiente articulo.
1 Agnew, H., Alivar-Agnew, M. 6.3 Contando Átomos por el Gramo. Con licencia de CK-12.
2 Centro Nacional de Información Biotecnológica (2023). Resumen del Compuesto PubChem para CID 962, Agua.
