El cloro afecta al pH?

Todos los productos químicos que utilizamos, incluyendo las diferentes presentaciones de cloro, tienen un pH diferente, pero su impacto en el pH de la piscina no siempre es significativo. En este artículo discutimos cómo cada tipo de cloro influenciará al pH en el agua y porqué.
En este articulo:
- Diferentes tipos de cloro y su impacto en el pH
- Cloro líquido (Hipoclorito de sodio)
- Hipocal (Hipoclorito de calcio)
- Por qué el hipocal enturbia el agua?
- Dicloro (Dicloro-s-triazinetriona de sodio dihidratado)
- Tricloro (Tricloro-s-triazinetriona)
- Generadores de cloro salino (SWG)
- Cloro gas (Cl2)
- La formación del acido clorhídrico (HCl) y como neutraliza los tipos de cloro alcalinos
- Conteniendo el pH de la piscina
- Conclusión
Los diferentes tipos de cloro y su impacto en el pH
Cada tipo de cloro tiene un efecto diferente en la química del agua. A continuación le presentamos algunos de los tipos de cloro más populares para piscina:
- Cloro liquido (hipoclorito de sodio)
- Hipocal (Hipoclorito de calcio)
- Tricloro (Tricloro-s-triazinetriona)
- Dicloro (Dicloro-s-triazinetriona de sodio dihidratado)
- Generadores de cloro salino
- Cloro gas (Cl2⇡)
En este artículo hablaremos brevemente de cada tipo de cloro, centrándonos más en su impacto en el pH. Siga el siguiente vínculo si desea información más detallada acerca de cada tipo o presentación de este químico tan utilizado en las piscinas.
1. Cloro liquido (Hipoclorito de sodio)
.png?width=800&height=450&name=4.9%20Water%20Chemistry%20-%20Total%20Dissolved%20Solids%20(TDS).png)
El cloro líquido es producido de diferentes maneras fundamentalmente disolviendo cloro gas en una solución de hidróxido de sodio (sosa caustica) en un ambiente controlado. El resultado es hipoclorito de sodio, agua y sal. La ecuación se ve de la siguiente manera:
Cl2⇡ + 2NaOH → NaOCl + NaCl + H2O
Cloro (gas⇡) + Hidróxido de sodio → Hipoclorito de sodio + Sal + Agua
El hipoclorito de sodio tiende a tener una reacción con el agua, como se muestra a continuación, y en base a esa reacción luego se producen los subproductos cloradores, el acido hipocloroso (HOCl) y derivados de este, el ion hipoclorito (OCl-) y el HCI: (HOCl ⇌ H+ + OCl-).
NaOCl + H2O ⇌ HOCl + NaOH
Hipoclorito de sodio + Agua → Ácido hipocloroso + Hidróxido de sodio
Las reacciones de disociación del hipoclorito de sodio y por ende la producción efectiva del acido hipocloroso y el ion hipoclorito dependen en sí del pH. Un pH más acido o neutro conduce a la ecuación anterior a inclinarse hacia la derecha. Por ende para poder estabilizar el producto líquido es necesario que la solución sea altamente alcalina (debido a que tanto el HOCl como el OCl- tienden a degradarse rápidamente). Por esa razón la mezcla es enriquecida con hidróxido de sodio y agua, manteniendo el pH entre 12-13, empujando la ecuación hacia la izquierda y extendiendo la vida útil del producto.1
Obviamente, una vez que el cloro líquido es agregado en la piscina, el pH generalmente entre 7.2 y 7.8 conduce la ecuación a la derecha, hacia la formación de acido hipocloroso y el ion hipoclorito y también a la liberación de sodio e hidróxido:
NaOCl + H2O ⇌ HOCl + Na+ + OH-
Hipoclorito de sodio + Agua → Ácido hipocloroso + Ion de sodio + Ion de hidróxido
El pH alcalino del producto sin embargo tiende a causar un pequeño incremento en el pH de la piscina general, lo cual conllevaba a ciertos mitos de tener que neutralizar con acidez para contrarrestar este efecto. Sin embargo como lo explicaremos más tarde el pH bajará por sí mismo después de una serie de reacciones de oxidación o desinfección, por lo que la neutralización con acido extra es realmente innecesaria.
2. Hipocal (Hipoclorito de calcio)

El hipoclorito de calcio (Ca(OCl)2) se disuelve en el agua y genera acido hipocloroso (HOCl) e hidroxido de calcio (Ca(OH)2). Es un tipo de cloro bastante alcalino con un pH que se encuentra entre 10-11.8, dependiendo de la concentración del producto. Al igual que el cloro líquido, eleva el pH ligeramente de manera temporal. Obviamente que la magnitud de este impacto depende de la dosis utilizada o en otras palabras la cantidad de producto agregado en respecto con el tamaño de la piscina.
El hipocal se puede fabricar de un par de maneras diferentes. Una de ellas es la exposición controlada de cloro gas con hidróxido de calcio.2 Así se ve la reacción química:
2Cl2⇡+ Ca(OH)2 → Ca(OCl)2 + 2HCl
Cloro (gas⇡) + Hidróxido de calcio → Hipoclorito de calcio + Ácido clorhídrico
Luego al agregar el hipoclorito de calcio al agua, la siguiente reacción es producida:
Ca(OCl)2 + 2H2O → 2HOCl + Ca(OH)2
Hipoclorito de calcio + agua → Acido hipocloroso + Hidroxido de calcio
Por qué el hipocal enturbia el agua?
La naturaleza de este fenómeno está en los subproductos del hipoclorito de calcio y su no muy rápida disolución. Cuando el producto se agrega en cantidades considerables y sin diluir, el pH se eleva rápidamente en una zona localizada al liberar el hidróxido de calcio (Ca(OH)2). Esto provoca una sobresaturación del ISL lo cual promueve que ese mismo calcio luego interacture con los iones de carbonato y bicarbonato en el agua para formar carbonato de calcio (CaCO3), famosamente conocido como sarro una vez que se ha precipitado por completo, adherido a superficies y endurecido, sin embargo cuando la reacción es repentina el fenómeno se observa como agua lechosa o agua turbia.
Esta reacción es similar a la que ocurre al agregar carbonato de sodio, también en cantidades considerables y sin diluir.
Para evitar causar agua turbia al agregar carbonato de sodio o hipoclorito de calcio, siga los siguientes consejos:
- Reduzca el pH a menos de 7.8 antes de agregar el químico
- No agregue fuertes dosis del químico, divida las dosis si es necesario. Siempre diluya
- Vierta alrededor del perímetro o en diferentes áreas
- Asegúrese de circular el agua mientras agrega el producto
3. Dicloro (Dicloro-s-triazinetriona de sodio dihidratado)
Vaya que de este tipo de cloro hemos hablado mucho en el pasado debido a su contribución a los niveles de CYA. En esta ocasión seremos breves ya que el pH de este tipo de cloro es relativamente neutral, entre 6.0 y 7.0 dependiendo de la pureza del producto. 3
Puede que reduzca ligeramente el pH en su piscina, pero en la gran mayoría de los casos el efecto es negligible. Por esa razón tampoco tendrá un impacto negativo en la alcalinidad.
Como lo comentamos en nuestro último artículo, el subproducto principal del dicloro es el acido isocianurico. Por peso únicamente el 27.7% del dicloro es cloro, mientras que el 49.2% es CYA.4 Una libra de dicloro incrementará el CYA por 5-6 ppm en una piscina de 10,000 galones, según la concentración del producto.
4. Tricloro (trichloro-s-triazinetrione)

Hasta este punto, los tipos de cloro anteriormente mencionados tienen casi 0 impacto en el pH a largo plazo. Si, el cloro líquido y el hipocal pueden elevar el pH ligera o considerablemente dependiendo de la cantidad utilizada pero este efecto es temporal. Por otra parte el dicloro puede reducir el pH, pero este tendrá la tendencia a subir por sí solo en no mucho tiempo.
Con el tricloro, sin embargo, la dinámica es bastante diferente. El tricloro puede fácilmente reducir el pH y la alcalinidad de la piscina. Especialmente por que es un tipo de químico que se desenvuelve de la negligencia y el abuso, gracias a su presentación más popular en forma de tabletas de disolución lenta.
El tricloro también se puede presentar en forma granular, y tiende a disolverse mucho más rápido de esta manera. Sin importar la presentación del producto, el tricloro es bastante acido con un pH entre 2.8 y 3.0 y debido a ello tiene un impacto significativo en la química de la piscina.
Cuando el tricloro se disuelve en la piscina neutraliza la alcalinidad de bicarbonato, lo cual significa que conduce a que iones de hidrógeno (H+) interactúen con iones de bicarbonato (HCO3-) para formar acido carbonico (H2CO3).5 Esto representa una reducción en la alcalinidad total y al mismo tiempo un decremento en el pH.
Adicionalmente, como con el dicloro, el ingrediente principal del tricloro es el acido isocianurico. Por peso únicamente el 45.8% es cloro, mientras que más del 53% es CYA (esto depende en la pureza del producto ya que puede contener diferentes ingredientes de relleno o estabilización). Una libra de tricloro introducirá alrededor de 6 a 6.7 ppm de CYA en una piscina de 10,000 galones. 6
5. Generadores de cloro salino
.jpg?width=760&height=434&name=salt%20chlorine%20generator%20(spanish).jpg)
Cualquier persona que haya mantenido una piscina de sal sabe que el pH tiene la tendencia a subir. A veces existe la percepción que el pH se elevaría indefinidamente, cuando en la realidad existe un límite natural que nosotros conocemos como el techo del pH.
La creencia popular es que las celdas generadoras elevan el pH químicamente gracias a los subproductos alcalinos en el proceso, como el hidróxido de sodio (soliamos apoyar esta creencia). Mientras que es verdad que hidroxido de sodio es producido durante el proceso, la verdadera razón del incremento en el pH es la aireación y agitación forzada debido a la producción también secundaria de hidrógeno gas:
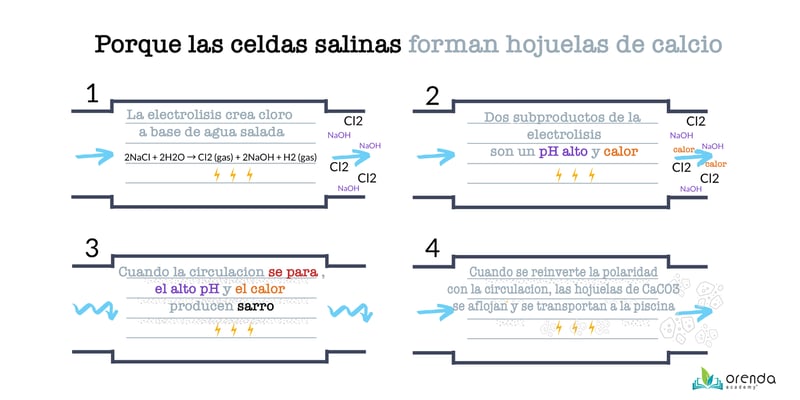
Hablamos más acerca del funcionamiento de la sal y su efecto en la conductividad y corrosión del agua en este artículo.
En términos simples la sal al disolverse se disocia en iones de sodio y cloruro (Na+ and Cl-). Esta agua salina luego fluye a través de la celda en donde los electrodos polarizados atraen dichos iones. El cátodo es el polo negativo (-) en la electrólisis atrayendo así los iones de sodio, y el ánodo es el polo positivo(+) atrayendo los iones de cloruro.7
Catodo (-)
Na+ + (e-) → Na
Ion de sodio + electrón → Sodio elemental
Aunque teóricamente en el cátodo se produciría sodio elemental, en la práctica es mucho más fácil reducir agua (H2O), por lo que únicamente la siguiente reacción está presente:
2H2O + 2(e-) → H2⇡ + 2OH-
Agua + 2 electrones → Hidrógeno (gas⇡) + 2 hidroxidos
Anodo (+)
2Cl- → Cl2⇡ + 2(e-)
2 iones de cloruro→ Cloro (gas⇡) + 2 electrones
Teóricamente el agua también podría ser oxidada en el ánodo:
2H2O → O2⇡ + 4(e-)+ 4H+
2 moléculas de agua → oxígeno (gas⇡) + 4 electrones + 4 iones de hidrógeno
Sin embargo debido a que la solución (el cuerpo de agua de la piscina) tiene un porcentaje muy bajo de sal en términos de volumen; 3500 ppm por ejemplo es únicamente un 0.35%. Resulta mucho más fácil oxidar el ion de cloruro, por lo cual únicamente cloro gas es producido en el ánodo. La reacción total de ambos ánodos es representada por la siguiente ecuación:
2NaCl + 2H2O → 2NaOH + H2⇡+ Cl2⇡
2 moleculas de sal + 2 de agua → 2 hidroxido de sodio + Hidrógeno gas (gas⇡) + Cloro (gas⇡)
Además del hidróxido de sodio, esta reacción produce dos gases: cloro e hidrogeno, los cuales promueven la aireación y el escape también del dióxido de carbono en el agua, y esto a su vez provoca que el pH se eleve a su limite natural mas rapidamente, como ya lo hemos planteado en el pasado, la pérdida de dióxido de carbono ocasiona que el pH se eleve.
6. Cloro gas (Cl2⇡)
Este tipo de cloro solia ser bastante popular hace un par de décadas pero debido a su volatilidad y acidez, los diferentes organismos gubernamentales, las leyes de transportación y almacenamiento, y las diferentes legislaciones de los productos químicos con fines recreativos han desarrollados tantos obstáculos contra su uso que es difícil encontrarlo hoy en dia. Es una sustancia bastante ácida debido a como interactúa con el agua directamente:
Cl2⇡ + H2O → HOCl + HCl
Cloro (gas⇡) + Agua → Ácido hipocloroso + Ácido clorhídrico
Al agregarlo a la piscina reduce notablemente el pH y la alcalinidad debido a que no solo agrega acido clorhídrico directamente, sino que a medida que el acido hipocloroso (HOCl, la parte fuerte del cloro) se encarga de desinfectar u oxidar contaminantes, este pierde el oxígeno en el proceso, lo que nos lleva a más HCl y también a nuestro siguiente punto.
La formación de acido clorhídrico (HCl) a raíz del cloro
Recuerda como mencionamos que no era necesario neutralizar el pH alcalino del cloro líquido y del hipocal después de agregarlos?. Y como también establecimos que el aumento de pH en una piscina de sal se debe a la pérdida de CO2 y NO a la producción de 2 NaOH?
Resulta que en cada ocasión se produjo HOCl y subproductos. El HOCl despues sera descompuesto ya sea al destruir contaminantes y desechos o por el sol en sí. El resultado es HCl lo cual neutraliza perfectamente el hidróxido producido en el cloro líquido o por el hipocal.
En las piscinas de sal de hecho tenemos la misma reacción que observamos con el cloro gas al disolverse en el agua debido a que uno de los productos de la electrólisis es el cloro en forma gas, este al disolverse produce HOCl y HCl, y el HOCl despues HCl, lo cual neutraliza completamente los dos NaOH.
.jpg?width=800&height=450&name=Self%20neutralization%20of%20the%20different%20types%20of%20chlorine%20(spanish).jpg)
El cloro gas no tiene contrapartes neutralizantes, y es por eso mismo que es tan acido y produce un impacto significativo al reducir el pH y la alcalinidad.
Es importante remarcar que cada una de estas reacciones toma tiempo y una cadena de diferentes interacciones químicas que se pueden producir en la piscina, y es por eso que es difícil apreciar la neutralización en tiempo real. De ahí la noción de que los tipos de cloro alcalinos elevan el pH en la piscina.
Conteniendo el pH
Cuál es la conclusión entonces? Deberíamos manejar un diferente enfoque dependiendo del tipo de cloro primario en la piscina?
Nosotros creemos que asi deberia de ser, aunque las diferencias son pequeñas, en el programa Orenda promovemos:
- Cuidado proactivo
- Evitar el uso de químicos conflictivos
- Evitar el uso de químicos que dejen subproductos a largo plazo que puedan ser dañinos.
Enseñamos como realizar un mantenimiento de piscina usando las leyes de fisica y quimica a nuestro favor sin tener que forzar ciertas condiciones en la piscina, mientras se rige el equilibrio del ISL todo el año.
Una de esas condiciones se desenvuelve del pH. Reconocemos que el pH siempre tendrá la tendencia a subir en la gran mayoría de las piscinas con acabado cementoso. Esto debido a la gran concentración de calcio en el acabado y a que la alcalinidad de carbonato contiene CO2 el cual tendrá la tendencia a escapar, afectando así el equilibrio del pH, permitiendo que se eleve.
En base a eso tenemos algunos puntos clave:
- La temperatura del agua y sus cambios durante las diferentes temporadas del año pueden ser la base para determinar sus niveles ideales de dureza de calcio. Un agua mas fria requiere más calcio para prevenir agua agresiva con baja saturación
- La alcalinidad ideal dependerá del tipo de desinfectante que utiliza. Si usa productos cloradores alcalinos le recomendamos una alcalinidad más baja de lo normal, esto le pondrá un techo a su pH y procurará el equilibrio del ISL en los extremos más altos del pH.
- No recomendamos el uso primario de tabletas de tricloro. Este elevará sus niveles de CYA rápidamente y con su uso es necesario mantener una alcalinidad más alta de lo normal ya que el pH se mantendrá suprimido.
Puede escuchar nuestro podcast para entender estos conceptos a mayor detalle:
Conclusión
Con la excepción del tricloro, los productos cloradores no tienen un impacto notable en el pH o alcalinidad a la larga. Si, los tipos de cloro alcalinos elevan temporalmente el pH pero este cambio será neutralizado después de una cadena de reacciones de desinfección y oxidación.
Las piscinas de sal y sus generadores son químicamente neutras en cuestión con el pH pero debido a la turbulencia y el escape de los gases, estas piscinas tienden a causar que el techo del pH se alcance más rápido por lo que es comun encontrarlas en un margen de pH mas alto.
Esperamos que esta información sea clara y concisa y le sea de ayuda para entender lo que pasa cuando el cloro es agregado al agua.
1 OxyChem (2014). Manual de Hipoclorito de Sodio.
2 Ropp, R.C. (2013). Compuestos de la Familia 17 (H, F, Cl, Br, I) - Hipoclorito de Calcio. Enciclopedia de los Compuestos Alcalinotérreos. Capítulo 2, (pp. 25-104). https://doi.org/10.1016/B978-0-444-59550-8.00002-8
3 Esta presentación de diapositivas de la EPA de EE. UU. indica que el pH tanto del dicloro de sodio anhidro como del dicloro de sodio dihidrato es de 6.0 a 7.0, en una solución al 1%. Debido a su volatilidad, no usamos dicloro anhidro en la industria de las piscinas. Todos los productos de dicloro para piscinas son dicloro-s-triazinetriona dihidratada de sodio. La presentación de la EPA se cita aquí, con un PDF descargable:
Wahman, D. (2018). Implicaciones de la Química del Agua de Dicloro y Tricloro. Agencia de Protección Ambiental de EE. UU., 15º Taller Anual de Sistemas Pequeños de la EPA. Diapositiva 10. PDF descargable aquí.
4 Mostramos el cálculo para esto (y todos los demás productos de cloro) en nuestro artículo anterior, aquí.
5 Wojtowicz, J. (2001). El Sistema de Carbonatos en el Agua de Piscina. Revista de la Industria de Piscinas y Spas. Vol. 4(1), pp. 54-59.
6 Mostramos los subproductos de cada tipo de cloro de manera precisa en los resultados de dosificación de la calculadora Orenda™. Con el tricloro por ejemplo, el cálculo se deriva asumiendo que es del 99%, pero eso se indicará en la etiqueta del producto utilizado y esto puede variar. En base a este porcentaje, una libra de tricloro aumenta el cloro en 11 ppm en 10,000 galones y aumenta el CYA en 6.68 ppm.
7 Celdas Electrolíticas. Sitio web de Investigación Bodner, Departamento de Química de la Universidad de Purdue.
