Qué es el bromo como desinfectante?

El bromo es la alternativa más popular al cloro para la desinfección en las piscinas. Ambos son elementos químicos halogenos y comparten propiedades similares, pero cómo se diferencian? Cual es mejor para su piscina? Cual es mejor para la salud del usuario? descubra todo eso y más en este artículo.
En este articulo:
- Qué es un desinfectante residual en una piscina?
- Bromo
- Tipos de bromo
- La química de la desinfección con bromo
- La relación con el pH
- Comparación de dosis entre cloro y bromo
- Porque el bromo produce un tinte verdoso en el agua?
- El ciclo del bromo
- Subproductos del bromo
- Bromaminas
- Trihalometanos (THM)
- Bromatos
- Qué tipo de sistemas secundarios puedo utilizar en una piscina de bromo?
- Puedo utilizar cloro en una piscina de bromo?
- El bromo puede tomar el control en una piscina de cloro
- Conclusión
Qué es un desinfectante residual?

Este es un tipo de desinfectante o sanitizante que puede eliminar o reducir microorganismos en un ambiente de manera prolongada gracias a cierta permanencia. En una piscina, un desinfectante residual circula en el cuerpo de agua y a través del sistema de filtración, proporcionado así una línea de defensa contra las enfermedades, o virus y bacterias que pueden existir en un ambiente acuático y ser nocivas para la salud. Este tipo de enfermedades son lo que la CDC o el centro de control de enfermedades de los Estados Unidos conoce como enfermedades de agua recreativa (RWIs por sus siglas en inglés).
Este tipo de desinfectante y su residuo pueden ser medidos con un kit de prueba que refleja las lecturas en partes por millón (ppm), o el equivalente en el sistema métrico miligramos por litro (mg/L). Un sistema de desinfección secundario es aquello que se utiliza como apoyo, como los rayos UV, el ozono, o el AOP. Estos sistemas son de punto de contacto y no generan un residuo en el agua.
Por mucho, el desinfectante residual más popular es el cloro. Sin embargo en este artículo hablaremos del segundo más popular, el bromo. Aunque estos productos tienen el mismo objetivo, la química que se desarrolla en la piscina es bastante diferente.
Bromo

En los Estados Unidos el bromo es más comúnmente utilizado en jacuzzis o spas y no mucho en piscinas. Principalmente por conveniencia ya que el bromo se ofrece en pequeñas tabletas que se disuelven lentamente y trabajan bien en ambientes con mucha aireación y turbulencia como en los spas.
A pesar de que el bromo es más costoso y más débil que el cloro, es el producto de elección para spas. Tal vez por que los subproductos de la desinfección (bromaminas) son menos nocivas y no tan irritantes como los subproductos derivados de la desinfección con cloro (cloraminas) o tal vez porque el químico en si se disuelve más lentamente y debido a eso tiene mejor rendimiento. Cualquiera que sea la razón, la demanda del usuario es lo que mantiene este químico en el mercado.
Si se pretende utilizar bromo en una piscina, solo debería de utilizarse en piscinas interiores ya que el bromo no puede ser protegido contra la degradación por la luz solar o los rayos UV. A diferencia del cloro que cuenta con el acido isocianurico que actúa como protector solar, no hay un equivalente para el bromo.
Tanto el cloro como el bromo son parte de la columna de elementos halógenos en la tabla periódica. Cada elemento en esta columna, gracias a sus propiedades, tiene la capacidad de desinfectar y también producir sales al combinarse con el sodio. El cloruro de sodio (NaCl) es la sal de mesa más comun que todos conocemos, mientras que el bromuro de sodio (NaBr) es una sal relevante para el artículo de hoy, de la cual estaremos discutiendo en unos momentos.
El bromo es de hecho un elemento menos reactivo, y por lo tanto menos efectivo para la desinfección. Debido a la diferencia en los estados de oxidación, el cloro es un agente oxidante más fuerte lo cual permite que el cloro oxide los iones de bromuro de vuelta a bromo activo, de manera indefinida. Esto es un dato importante a recordar.
Tipos de bromo para piscinas
El bromo se puede encontrar en tabletas, briquetas, gránulos y de forma líquida. Cada uno de estos productos es diferente y por ende tiene un impacto distinto en la química general de la piscina, específicamente en el pH.
Según el instituto de entrenamiento para química de piscinas (Pool Chemistry Training Institute), existen 3 tipos de productos de bromo utilizados en agua recreativa:1
- Bromo en un sistema dual (Bromuro de sodio + un oxidante separado)
- El pH es neutro debido a que el bromuro de sodio, siendo una sal, no afecta el pH.
- Requiere un oxidante separado para oxidar, o en otras palabras reactivar, los iones de bromuro.
- El bromuro de sodio es de hecho un tipo de alguicida muy comun, pero en realidad es solo una sal. Este producto dejará iones de bromuro en el agua (Br-), los cuales al oxidarse crean acido hipobromoso (HOBr), el desinfectante activo. Si se usa este tipo de alguicida en una piscina de cloro, muy pronto los niveles se acumularan y la piscina será de hecho irreversiblemente una piscina de bromo.
- Tabletas o barras de BCDMH (bromo-cloro-5,5-dimetilhidantoína)
- 4.5-4.8 de pH (moderadamente ácido debido al HOCl creado)
- Fórmula química: C5H6BrClN2O2
- Contiene algo de cloro, y se crearán tanto HOBr como HOCl.
- El producto de bromo más popular del mercado.
- No requiere un oxidante separado para funcionar, aunque se recomienda comenzar con bromuro de sodio para construir un "banco de bromuro" al usar este producto por primera vez.
- Tabletas o briquetas de DBDMH (dibromo-5,5-dimetilhidantoína)
- pH de aproximadamente 6.6 (relativamente neutral)
- Fórmula química: C5H6Br2N2O2
- Libre de cloro
- También requiere un oxidante separado para oxidar los iones de bromuro de vuelta a bromo activo
La química de la desinfección con bromo
Muy similar a como funciona el cloro, cuando cualquier tipo de producto químico a base de bromo se disuelve en el agua, se crea la parte activa, el acido hipobromoso (HOBr), el cual es el equivalente al acido hipocloroso con el cloro (HOCl). La química se ve de la siguiente manera:
Br2 + H2O → HOBr + HBr
bromo + agua → ácido hipobromoso + ácido bromhídrico
Luego el acido hipobromoso (HOBr) se disocia en hidrógeno y el ion hipobromito, tal como el HOCl se disocia en hidrógeno y el ion hipoclorito.
HOBr ⥄ H+ + OBr-
El ácido hipobromoso se disocia en hidrógeno y el ion hipobromito
Si tiene buena atención al detalle probablemente se percato del signo (⥄) en lugar del signo de proceso reversible (⇌). Esto es porque este equilibrio ocurre en base a niveles de pH mayores que los manejados en el mantenimiento de una piscina. Por lo general la gran mayoría del bromo en el agua de una piscina o spa se encontrará en forma de HOBr.
El impacto del pH en el bromo
Tal como en una piscina de cloro sin CYA, el pH influencia directamente el porcentaje o equilibrio entre la parte fuerte y la parte débil del desinfectante. Entre más bajo sea el pH, mayor será el porcentaje de HOBr, y por ende menores los tiempos de contacto (TC) necesarios para eliminar patógenos. Y debido a que no existe un químico similar al CYA para el bromo, el pH siempre determinara el % de HOBr en una piscina de bromo.
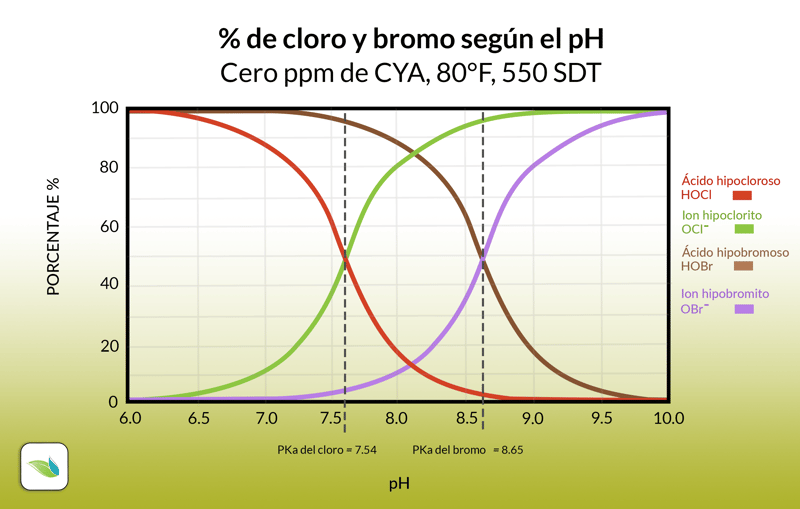
Valores pKa
Mientras que el cloro muestra porcentajes entre sus subproductos del 50/50 a un pH de 7.54, el bromo lo hace a un pH de 8.65. Estos puntos de pH son conocidos como los valores pKa, los cuales son un buen indicador de los equilibrios químicos en ciertos aspectos, y mientras que es posible que desarrollemos un artículo a mayor profundidad, por ahora es más que suficiente saber que en estos niveles las reacciones se encuentran en un equilibrio de 50% y 50% con los conjugados.
Con el bromo, esto de hecho son buenas noticias porque incluso a un pH de 8.65, ya tendra 50% de HOBr. Habitualmente manteniendo el pH de la piscina entre 7.5 - 8.0 puede esperar un porcentaje incluso mucho mayor, lo que significa un desinfectante más poderoso. Puede observar los equilibrios según los diferentes niveles de pH en la siguiente gráfica:
Dosis de bromo en comparación con las dosis de cloro
El bromo es más débil que el cloro en términos de desinfección. También es más débil como oxidante y más pesado, todo esto implica que aproximadamente se requieren 2.25 veces la cantidad de bromo para hacer el mismo trabajo en comparación con el cloro (en ppm).2 Según los libros educativos de Bob Lowry, el nivel ideal de bromo en una piscina es entre 4.0 y 6.0 ppm.
El bromo elimina gérmenes y alga tal como el cloro, y otros elementos halógenos lo hacen. Ataca las paredes celulares y destruye a los patógenos desde adentro. Oxida también de manera similar, es solo que es más débil que el cloro y por ende toma mayores cantidades.
Porque el bromo produce un tinte verdoso?
 Si alguna vez ha observado una piscina de bromo en contraste con una de cloro, tal vez se ha percatado que el tinte en el agua es un poco distinto. Entre mas profunda sea la piscina, mas notable sera. Este tinte verdoso se debe principalmente al bromo en sí. Segun Richard Falk:
Si alguna vez ha observado una piscina de bromo en contraste con una de cloro, tal vez se ha percatado que el tinte en el agua es un poco distinto. Entre mas profunda sea la piscina, mas notable sera. Este tinte verdoso se debe principalmente al bromo en sí. Segun Richard Falk:
"El bromo tiene color natural marrón cuando se encuentra en altas concentraciones y amarillo cuando está diluido. Si tiene una piscina de color azul verdoso, es porque el color amarillo más el color azul producen verde. El agua de la piscina naturalmente es azulada si es lo suficientemente profunda porque el rojo de la luz solar es absorbido por el agua, dejando que el azul pueda ser reflejado y ser observado más fácilmente. Así que es la combinación del amarillo del bromo más el azul del agua. -Richard Falk 6
El ciclo del bromo
Y asi como el acido hipocloroso es reducido en iones de cloruro (Cl-), el acido hipobromoso se reduce en iones de bromuro (Br-) después de oxidar o eliminar contaminantes, pero ahí es en donde comienzan las discrepancias entre los 2 sistemas.
Sin un generador de cloro salino, los iones de cloruro (las sales) terminan siendo inertes e inútiles. En cambio cuando se utiliza la electrólisis, los generadores de cloro "recargan" estos iones y los convierten en cloro (Cl2) en forma de gas para reiniciar el ciclo de descontaminación. Pero de hecho los iones de bromuro pueden ser "recargados" o regenerados a la forma activa del desinfectante, el acido hipobromoso (HOBr), con un oxidante. Debido a los estados de oxidacion de los 2 elementos y sus propiedades, incluso el cloro puede usarse como oxidante para reactivar dichos iones de bromuro.3 El sistema en términos simples se ve de la siguiente manera:
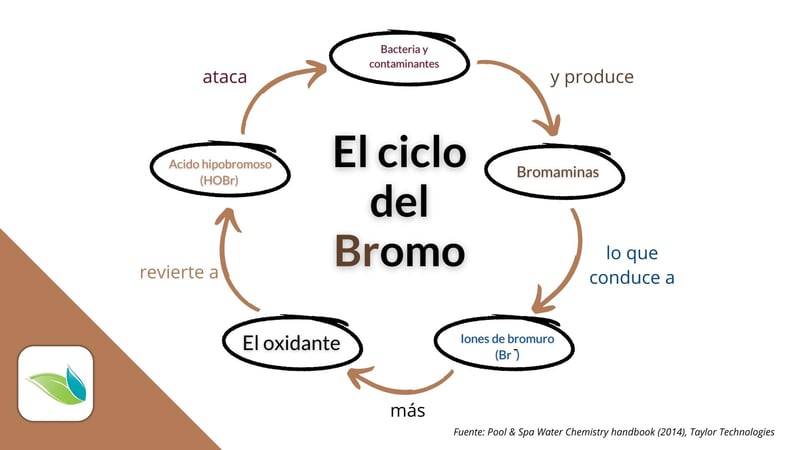
Y no solo el cloro tiene la habilidad de oxidar los iones de bromuro y convertirlos en bromo activo. Los sistemas de oxidación secundaria como el ozono y el AOP también tienen este beneficio, asi como tambien el agente oxidante libre de cloro conocido como monopersulfato de potasio.4
Pero como lo explicaremos más adelante en este artículo, los sistemas secundarios tienen ciertos inconvenientes cuando se trata de piscinas de bromo. Para resumir las diferencias entre el cloro y el bromo podemos establecer los siguientes hechos:
- Los iones de cloruro (Cl-) son inertes a menos que se recarguen por electrólisis, lo que ocurre en un generador de cloro salino. La electrólisis genera cloro gaseoso (Cl2) y otros subproductos.
- Los iones de bromuro (Br-) pueden ser recargados por cualquier oxidante, incluidos el cloro, el monopersulfato de potasio, el ozono (O3) y los radicales hidroxilo (•OH).
Entonces, aunque el costo inicial para el mantenimiento con bromo es menor, mantener activa una piscina de bromo es más costoso debido a la necesidad constante de tener que agregar un oxidante.
Subproductos del bromo
Bromaminas
El cloro ataca y destruye cualquier germen o contaminante, y como lo es el cloro, el bromo es bastante ineficiente al oxidar desechos orgánicos no vivos y aceites, y por esa razón debe de ser complementado con algún otro agente oxidante, especialmente en ambientes de alto uso y demanda, como los spas o jacuzzis.
Pero a diferencia del cloro, no se puede distinguir entre bromo total y bromo libre (el bromo combinado no es un factor medible, por la simple razón de que no es necesario medirlo). El bromo combinado, en gran parte las bromaminas tienen de hecho buena capacidad de desinfección.
Las bromaminas se crean cuando el bromo se combina con compuestos de nitrógeno, durante el proceso de oxidación.5 Luego son destruidas cuando suficiente HOBr se encuentra presente. El acido hipobromoso y las bromaminas producen los iones de bromuro (Br-), y el ciclo continúa.
Formación de bromaminas
HOBr + NH3 ⇌ NH2Br + H2O
Ácido hipobromoso + amoníaco ⇌ monobromamina + agua
HOBr + NH2Br ⇌ NHBr2 + H2O
Ácido hipobromoso + monobromamina ⇌ dibromamina + agua
HOBr + NHBr2 ⇌ NBr3 + H2O
Ácido hipobromoso + dibromamina ⇌ tribromamina + agua
Las bromaminas (como las cloraminas) tienen cierto poder de desinfección y son eventualmente reducidas a iones de bromuro (Br-). El acido hipobromoso (HOBr) puede también ser reducido al eliminar algas o bacteria. Estos iones de bromuro también conocidos como "el banco de bromo" pueden ser oxidados por un choque de cloro, o un choque con un producto sin cloro, o por un sistema secundario y crear nuevamente HOBr.6 El ciclo se repite.
Algunas fuentes sugieren que los subproductos de la desinfección del bromo, las bromaminas, no causan irritación o inconformidad. Pero eso es subjetivo debido a que las piscinas interiores de bromo si tienen un olor dinstictivo. Sin embargo, el bromo es notablemente menos agresivo que el cloro, lo cual puede parecer mejor para ciertos usuarios. Depende de la opinión personal y perspectiva de los usuarios.
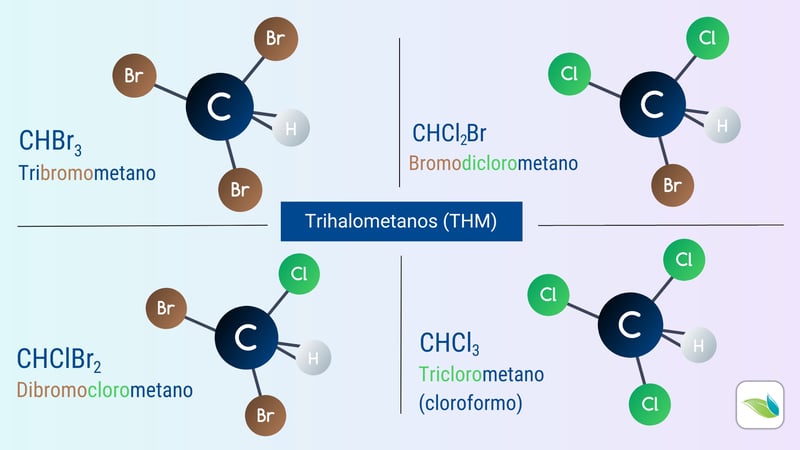
Trihalometanos (THM)
El mayor problema en las piscinas de bromo son en realidad los trihalometanos (THM). Solo uno de los cuatro trihalometanos (cloroformo) se puede crear en las piscinas de cloro porque el bromo no está en el agua. Pero si usa cloro para recargar el bromo o usa un producto como BCDMH (que contiene tanto bromo como cloro), los cuatro tipos de THM pueden producirse en el agua:
Bromatos
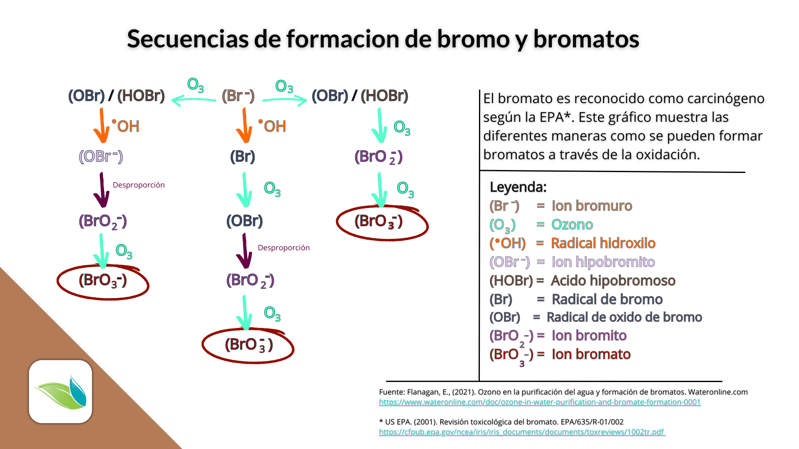
Tal vez el subproducto del bromo más peligroso para la salud es el bromato. El ion bromato (BrO3-) se produce conforme el bromo se descompone ante los rayos UV cuando se expone directamente a la luz solar o los sistemas UV. El ion bromato se ha clasificado como cancerígeno según la EPA.
Aquí hay un extracto de las conclusiones de la EPA sobre las halohidantoínas:
"La EPA ha determinado que existen riesgos potenciales de gran preocupación con el patrón constante del uso de productos de halohidantoína, aquellos que contienen bromo en piscinas al aire libre. Los riesgos solo se presentan en las piscinas al aire libre porque el ion bromato se forma con la exposición a la luz ultravioleta". - pág. 9 8
El informe de la EPA continúa con la siguiente declaración:
"En esta decisión provisional, la agencia requiere que todos los productos de halohidantoína que contienen ingredientes activos con bromo (códigos PC 006315, 006317, 006322, 006333 y 128989) eliminen su uso para piscinas al aire libre y agreguen etiquetas prohibitivas para jacuzzis y spas al aire libre." - pág. 12 8
Estudios como este son la razón por la cual recomendamos NO usar bromo en piscinas y spas al aire libre (a menos que el spa esté cubierto cuando no se use). Y no se trata SÓLO de piscinas al aire libre, como se sugiere en los extractos anteriores. Los bromatos también se forman en cualquier piscina o spa que tenga sistemas UV, ozono (O3), peróxido de hidrógeno (H2O2) o radicales hidroxilo (•OH). Con el ozono, por ejemplo, el ion bromuro (Br-) se recarga solo el 77 % de las veces, mientras que el otro 23 % del tiempo se oxida en el nocivo ion bromato (BrO3-).9
Que sistemas secundarios de desinfección pueden ser utilizados en una piscina de bromo?
En Orenda apoyamos los sistemas de desinfección secundaria en piscinas de cloro. Cumplen una función importante, especialmente en piscinas comerciales con alta demanda. Desafortunadamente, la mayoría de estos sistemas de desinfección secundaria son incompatibles con las piscinas de bromo debido a que crean bromatos.
- El ozono (O3) y los radicales hidroxilo (•OH) pueden crear bromatos a través de la oxidación.10
- Los sistemas UV y la luz solar directa crean bromatos a través de la fotólisis. 11
Las instalaciones tratadoras de agua potable y aguas residuales utilizan cada vez menos bromo debido a las limitadas opciones de oxidación sin crear bromatos. 12
Eso significa que solo tenemos un par de opciones cuando se trata de sistemas secundarios para piscinas de bromo, y cabe recalcar que ninguno de estos sistemas están registrados como sistemas de desinfección. El primero es el oxígeno hiper-disuelto. El segundo es la cavitación hidrodinámica (HDC por sus siglas en inglés). No hemos específicamente desarrollado estudios para comprobar la eficiencia de estos dos sistemas en piscinas de bromo, pero lo que si sabemos es que son completamente compatibles.
Es el bromo compatible con el cloro?
En terminos generales, el bromo no es compatible con el cloro, aunque depende las circunstancias...
Si utiliza el cloro como agente de choque para recargar "el banco" de bromo o si su producto de elección es el BCDMH, el cual contiene cloro, en una piscina cuyo desinfectante principal es el bromo, entonces si puede gozar del beneficio agregado siempre y cuando el cuerpo de agua no se encuentre al aire libre expuesto directamente a los rayos del sol. El cloro puede recargar los iones de bromuro de vuelta a acido hipobromoso (HOBr) para continuar con el ciclo de desinfección del bromo, y es de hecho la mejor alternativa ya que la oxidación con cloro no produce bromatos.
Si su piscina o spa es principalmente de cloro, no le recomendamos utilizar productos con bromo. Es muy comun que las personas utilicen el bromuro de sodio como alguicida sin darse cuenta que estan agregando bromo al agua. El bromuro de sodio (NaBr) es una sal que se disocia en iones de sodio e iones de bromuro. Luego el cloro recarga los iones de bromo y produce acido hipobromoso, el desinfectante. El problema son los iones de bromuro que después permanecerán en el agua, creando una demanda permanente de cloro durante su ciclo.
El bromo puede tomar el control
Debido a que el bromo se regenera, se queda en el agua de diversas formas. El uso continuo de productos a base de bromo convertirá muy rápidamente una piscina de cloro en una piscina de bromo. Esta conversión puede ocurrir sin que usted se de cuenta, en el momento en el que el agua tenga más iones de bromuro que de cloro libre. Solo se necesitan un par de ppm de bromo para convertir la piscina de cloro a piscina de bromo.11 La manera más práctica de regresar a la normalidad es drenando completamente. Aunque también se puede usar osmosis inversa o filtración con carbono activado.
El bromo también se puede reducir poco a poco conforme se escapa en forma gas, pero este proceso es muy muy lento y no recomendado como alternativa.
Entonces, cómo puede saber si su piscina de cloro se ha convertido en una piscina de bromo? Si es una piscina exterior, el primer síntoma es un consumo severo de cloro, mucho más alto de lo normal. Esto es porque es mucho más fácil para el cloro oxidar los iones de bromuro que cualquier otra cosa. Conforme el cloro oxida y crea acido hipobromoso, este al mismo tiempo se degrada rápidamente ante el sol y se descompone en iones de bromuro, lo que crea un ciclo de consumo de cloro interminable.
Segun este boletin, puede realizar un experimento en una cubeta para saber si su piscina es de cloro o de bromo, todo lo que implica es un producto de limpieza comun a base de amoniaco.13
Conclusión
Tanto el cloro como el bromo son elementos que tienen la capacidad de desinfectar y oxidar contaminantes orgánicos no vivos en un cuerpo de agua. El cloro es comparativamente más fuerte y por ende tiene la capacidad de oxidar el bromo, lo cual puede ser algo positivo. Especialmente cuando se intenta "recargar" el banco del bromo, esto también puede ser realizado efectivamente con otros tipos de agentes oxidantes, aunque puede ser una cuchilla con doble punta.
Si los iones de bromuro (Br-) son oxidados lo suficiente por sistemas como el ozono, el AOP o el peróxido de hidrógeno pueden formar los dañinos bromatos. Estos compuestos también pueden ser formados con la luz UV (ya sea la proveniente del sol o de los mismos sistemas UV). Debido a que el bromo no tiene un agente protector contra el sol (como el CYA para el cloro), no debería de usarse en cuerpos de agua al aire libre.
El bromo es una alternativa conveniente en spas o jacuzzis con bajo uso. Funciona de manera excelente en spas cubiertos ya que los subproductos de la desinfección son por significativamente menos irritantes. Existe una gran abundancia de información e investigaciones acerca del bromo aún pendientes y creemos que en el futuro el bromo será descartado para el uso en la industria de piscinas. Por ahora, si utiliza bromo como desinfectante, le recomendamos utilizar el monopersulfato de potasio o el cloro líquido como agentes oxidantes.
Esperamos que este artículo le sea de ayuda.
1 Lowry, Robert W. (2018). Química para piscinas residenciales. Cap. 14 (pág. 169). Pool Chemistry Training Institute.
2 Lowry, Robert W. (2018). Química para piscinas residenciales. Cap. 14 (pág. 172). Pool Chemistry Training Institute.
3 En el grupo de elementos halógenos de la tabla periódica, los elementos superiores pueden oxidar a los elementos inferiores. El cloro puede oxidar los iones de bromuro en bromo, y tanto el bromo como el cloro pueden oxidar los iones de yoduro en yodo. En teoría, el flúor podría oxidar los iones de cloruro en cloro, pero según esta fuente, el flúor es un oxidante demasiado poderoso que en realidad oxida el agua misma, por lo que las reacciones acuosas no pueden tener lugar. Esta es la razón por la cual el flúor no se usa en las piscinas, y el siguiente mejor halógeno (el cloro) es el desinfectante residual más dominante en el mercado.
4 Lampre, I., Marignier, JL, Mirdamadi-Esfahani, M., et.al. (2013). Oxidación de Iones Bromuro por Radicales Hidroxilo: Caracterización Espectral del Intermedio BrOH •- . Revista de Química Física. 117, 5. (págs. 877-887). https://doi.org/10.1021/jp310759u
5 Mensah, A., Berne, F., Allard, S., et.al. (2022). Modelado cinético del sistema bromo-amoníaco: Formación y descomposición de bromaminas. Investigación del agua, vol. 224. https://doi.org/10.1016/j.watres.2022.119058
6 El ozono puede "recargar" el bromo al oxidar los iones de bromuro en HOBr. Pero el ozono y el AOP también pueden convertir los iones de bromuro en bromatos dañinos. Esta es una química compleja, pero en resumen, el ozono puede oxidar el ion bromuro (Br-) en ácido hipobromoso (HOBr) y el ion hipobromito (OBr-). Pero si más ozono continúa oxidando HOBr o el OBr -, se crearán iones de bromito (BrO2-) y eventualmente iones de bromato (BrO3-). Puede encontrar una buena explicación y un gráfico de este proceso aquí.
7 "De los cuatro trihalometanos, solo los bromados son carcinógenos efectivos, ya que el cloroformo solo es carcinógeno a niveles citotóxicos que son bastante altos". - Correo electrónico privado con Richard Falk, junio de 2023. Hoja informativa de la EPA: bromodiclorometano.
8 EPA de EE.UU. (2021). Halohidantoínas: Decisión de revisión de registro provisional, Número de caso 3055. (págs. 9-12) N.º de expediente de la EPA de EE. UU. EPA-HQ-OPP-2013-0220.
9 Arroz, Rip G. (1995). Química del ozono para el tratamiento del agua de piscinas y balnearios municipales: realidades y falacias. Revista de la industria de piscinas y spas, vol 1. (1). (págs. 25-44). -- Esta referencia específica está en la página 36.
10 Haag, WR y Hoigne, J. (1983). Ozonización de aguas que contienen bromuro: cinética de formación de ácido hipobromoso y bromato. Ciencia y tecnología ambiental, 17 (5), 261-267.
11 Fang, J., Zhao, Q., Fan, C., et.al. (2017). Formación de bromato a partir de la oxidación de bromuro en el proceso UV/cloro con lámparas UV de baja y media presión. Chemosphere , 183, (págs. 582-588).
12 Kishimoto, N., Nakamura, E. (2012) Características de formación de bromato de la irradiación UV, la adición de peróxido de hidrógeno, la ozonización y sus procesos de combinación. Revista Internacional de Fotoenergía , vol. 2012.
13 Lowry, Robert W. (2019). Bromo o cloro: ¿Qué hay en su piscina? Instituto de Formación en Química de Piscinas, Boletín Técnico.

