Que es el punto de ruptura del cloro

La cloración del punto de ruptura es un concepto clave en la química de la piscina. En mayo de 2017, publicamos un artículo de dos partes sobre desinfectantes para piscinas. En la primera parte, comparamos diferentes tipos de cloro y sus pros y contras. Este artículo profundiza en la ciencia de la cloración. Exploramos la diferencia entre la cloración de punto de ruptura y la hipercloración (impactante).
Que es el punto de ruptura de la cloración?
El punto de ruptura de la cloración es el punto donde los niveles de cloro exceden la demanda de oxidante y el agua comienza a acumular un residuo de cloro libre disponible (CL o FAC). Teóricamente, exceder el "punto de ruptura" previene niveles elevados de subproductos desinfectantes (como cloraminas).
Cloro vs. Nitrógeno
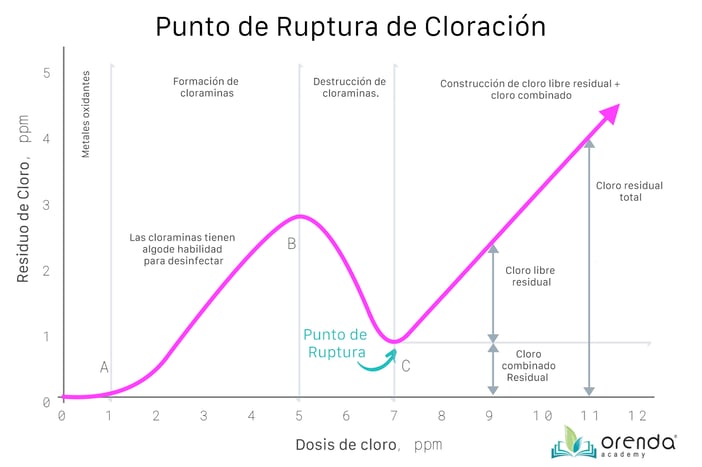
Analicemos el gráfico de arriba. Cuando agrega cloro al agua por primera vez, inmediatamente este comienza a oxidar metales como el hierro y el manganeso, que reducen el cloro. Esta reacción inicial elimina una cierta porción de cloro, por lo que no aparece nada en el gráfico hasta el punto (A). A medida que se agrega más cloro al agua, este reacciona al contacto con otros contaminantes, no solo gérmenes, sino también compuestos orgánicos no vivos y compuestos nitrogenados, que crean subproductos. Los orgánicos están basados en carbono y se oxidan con el cloro, reduciéndolo aún más. ¿Pero nitrógeno? El nitrógeno no se oxida tan fácilmente.
El amoníaco (NH3) y los contaminantes a base de nitrógeno como la urea se oxidan y se convierten en variaciones de las cloraminas cuando se combinan con el cloro. Esto se explicará con más profundidad en un momento ... pero sepa que las cloraminas en realidad tienen cierto potencial de desinfección y, por lo tanto, se miden con cloro total ... inicialmente.
 Entonces, ¿qué le sucede al amoníaco (NH3 ) cuando se encuentra con ácido hipocloroso (HOCl)? Bueno, el cloro comienza a reemplazar a los hidrógenos. Empecemos por el amoniaco.
Entonces, ¿qué le sucede al amoníaco (NH3 ) cuando se encuentra con ácido hipocloroso (HOCl)? Bueno, el cloro comienza a reemplazar a los hidrógenos. Empecemos por el amoniaco.

La reacción química que crea la monocloramina (NH2Cl) se ve así:
2NH 3 + 2HOCl → 2 NH2Cl + 2H2O
Amoníaco + ácido hipocloroso produce monocloramina + agua.
Observe que uno de los tres (3) hidrógenos del amoníaco fue reemplazado por un cloruro (Cl).
 La cloración adicional de la monocloramina crea dicloramina (NHCl2):
La cloración adicional de la monocloramina crea dicloramina (NHCl2):
2NH 2 Cl + 2HOCl → 2 NHCl 2 + 2H 2 O
Monocloramina + ácido hipocloroso produce dicloramina + agua
Aquí nuevamente, un hidrógeno más ha sido reemplazado por un cloruro (Cl).
 Y, por supuesto, incluso una cloración adicional produce la más nociva de las cloraminas que liberan gases de las piscinas, el tricloruro de nitrógeno, también conocido como tricloramina (NCl3 ):
Y, por supuesto, incluso una cloración adicional produce la más nociva de las cloraminas que liberan gases de las piscinas, el tricloruro de nitrógeno, también conocido como tricloramina (NCl3 ):
NHCl 2 + 3HOCl → NCl 3 + 3H 2 O
Dicloramina + ácido hipocloroso produce tricloramina + agua
Finalmente, todos los hidrógenos han sido reemplazados por cloruros para crear tricloruro de nitrógeno.
Las cloraminas son desinfectantes débiles
Como se señaló anteriormente, las cloraminas son desinfectantes, por lo que se les conoce como subproductos desinfectantes (SBP). De hecho, muchas plantas de tratamiento de agua agregan cloraminas a su agua como desinfectante secundario. Aunque débiles y lentas, las cloraminas contribuyen primero a los niveles totales de cloro porque ayudan con la desinfección. Esto, sin embargo, alcanza un umbral en el que el cloro activa las cloraminas, indicado en el punto (B). En otras palabras, el cloro oxida todos los contaminantes, lo que incluye las cloraminas después del punto (B) del gráfico. Es por eso que el nivel de cloro total cae con la adición de más cloro libre (el eje X en el gráfico).
La tendencia a la baja en el gráfico muestra que el cloro comienza a "ganar la batalla" contra los contaminantes hasta que oxida todo menos el cloro residual combinado. Este nivel de cloro residual se muestra en el gráfico en el punto (C). Si el cloro no puede superar la demanda de oxidantes, la demanda de cloro de su agua aumenta y el ORP disminuye. Esto parecería una tendencia descendente más prolongada hacia el punto de ruptura, porque el punto de ruptura estaría en una dosis mucho más alta de cloro. Cuando el cloro puede satisfacer la demanda de oxidantes, el agua ha alcanzado el punto de ruptura de cloración.
Cloro Libre Residual después del punto de ruptura
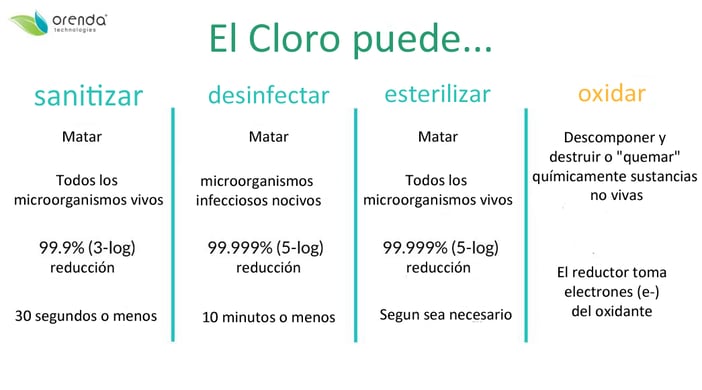
Solo después de que se haya abordado la demanda de oxidante puede ocurrir la desinfección. Por lo tanto, solo después de que se haya superado el punto de ruptura de la cloración puede acumularse un residuo de cloro libre. Hasta ese momento, el cloro tiene las manos ocupadas tratando de oxidarse hasta llegar al punto de ruptura.
Se necesita cloro libre disponible (CL o FAC) como desinfectante residual en el agua. El cloro combinado (CC) es el cloro que se combina con amoníaco y otros compuestos nitrogenados (incluidas las cloraminas y otros SBP). El cloro combinado es la medida más precisa de subproductos desinfectantes que podemos analizar. Cloro total disponible (CTD) = CL + CC. Medimos todos los tipos de cloro en partes por millón (ppm).
Solo recuerde, los kits de prueba no pueden diferenciar entre el ácido hipocloroso (HOCl) y su forma disociada y débil, el ion hipoclorito (OCl-). Entonces, aunque puede leer una buena cantidad de cloro libre disponible (CL), si su pH es alto o tiene altos niveles de fosfatos, es posible que aún tenga cloro débil en el agua. Si es así, su ORP lo reflejará.
Puede calcular cualquiera de los tres con sumas y restas. La mayoría de los kits de prueba miden el cloro total y libre, por lo que simplemente resta:
Cloro total - Cloro libre = Cloro combinado
Para eliminar el cloro combinado, se necesita una oleada de cloro, llamada hipercloración (o impactante) para superar la carga. La sabiduría convencional en el negocio de las piscinas es un impacto de 10 veces su nivel de cloro combinado en cloro libre adicional. Pero según el renombrado químico Richard Falk, la cifra de 10x no es exacta. Aquí hay una cita directa de Richard en el foro de PoolGenius Network:
"La proporción molar de cloro a amoníaco es 1.5:1 o 3:2, pero dado que el amoníaco se mide en unidades de ppm de N, mientras que el cloro se mide en unidades de ppm de Cl2, con el factor de 5.06 de diferencia, esta es una proporción de ppm de 7.6 a 1. Debido a que la formación de dicloramina requiere 2 moles de cloro por 1 mol de amoníaco y debido a las reacciones secundarias que pueden ocurrir, la proporción real de ppm de cloro a amoníaco es de alrededor de 8-10x, que es de donde proviene la regla de 10x. Sin embargo, esto es incorrecto ya que CC está en ppm de unidades de Cl2 (por lo que no hay factor de 5,06) y la monocloramina ya tiene 1 de 1,5 cloro adherido. Para oxidar la monocloramina, se necesita de 0,5 a 1,0 veces el nivel de CC. Incluso si el CC fuera urea, toma 2-3 veces el nivel de CC, no 10 veces. Por supuesto, cuanto más alto es el nivel de CC, más rápido ocurren las reacciones, pero la cantidad mágica no deberia de ser 10 veces". - Richard Falk
Hipercloración (choque)
Si su piscina tiene dificultades para alcanzar, y exceder, la cloración del punto de ruptura, el cloro que tiene no es suficientemente fuerte para hacer el trabajo. La demanda de oxidante es mayor que el cloro disponible para manejar la situación. La demanda de oxidantes en estos casos pueden ser cloraminas, compuestos orgánicos no vivos o cualquier combinación de ambos.
 Si aplica choques de cloro en su piscina con frecuencia para alcanzar el punto de ruptura de cloración, pregúntese cómo llegó allí. Claramente, los niveles normales de cloro en su piscina no son suficientes para satisfacer la demanda. Así que piense cómo llegó allí la demanda. El alto contenido de cloro combinado se debe generalmente a la introducción de amoníaco en la piscina. Descubra qué productos químicos se utilizan dentro y alrededor de la piscina. Piense en limpiadores de piscinas (muchos de ellos son a base de amoníaco) y alguicidas (muchos de ellos también son a base de amoníaco).
Si aplica choques de cloro en su piscina con frecuencia para alcanzar el punto de ruptura de cloración, pregúntese cómo llegó allí. Claramente, los niveles normales de cloro en su piscina no son suficientes para satisfacer la demanda. Así que piense cómo llegó allí la demanda. El alto contenido de cloro combinado se debe generalmente a la introducción de amoníaco en la piscina. Descubra qué productos químicos se utilizan dentro y alrededor de la piscina. Piense en limpiadores de piscinas (muchos de ellos son a base de amoníaco) y alguicidas (muchos de ellos también son a base de amoníaco).
Estamos a favor de un enfoque minimalista. ¿Por qué arrojar más cloro al problema sin hacer un esfuerzo por descubrir la raíz del problema? ¡El cloro no está diseñado para ser un oxidante primario! Está diseñado para ser desinfectante.
Si tiene hipercloración rutinaria de su piscina, esperamos que reconsidere sus prácticas. Aplicar la química adecuada para las situaciones adecuadas puede minimizar los costos, maximizar la eficiencia y mejorar la experiencia general del nadador. Si lo hacemos bien, la cloración del punto de ruptura será fácil de alcanzar y usted puede tener un residuo seguro de cloro libre disponible para mantener el agua segura. Identifique las fuentes de amoníaco y evite que entren en el agua. También recomendamos complementar el cloro con enzimas para eliminar las sustancias orgánicas no vivas y los aceites.
Gracias por tomarse el tiempo de leer este artículo tan largo y detallado. ¿Quiere aprender más sobre el tema? Contactenos.