¿Qué causa un pH alto en una piscina?

Es muy común que el pH aumente, y esto puede ocasionar todo tipo de problemas, como polvo de calcio, lo que se refleja en ocasiones como agua turbia y el fastidioso sarro. Pero, qué causa que el valor del pH se eleve en primer lugar? Por qué el pH a veces sube y otras veces se mantiene relativamente estable? En este artículo, hablaremos acerca del pH y cómo y porqué cambia, y esperamos ofrecer algo de claridad y alivio a este ciclo vicioso.
En este articulo:
¿Qué es el pH?
De manera breve, la palabra pH proviene del término poder de hidrógeno, y su raíz científica "potenz Hydrogen" o "potencial de hidrógeno" dependiendo de la fuente de informacion. El pH es un número logaritmo negativo que representa la concentración de hidrógeno en una escala de cero a catorce (0-14), siete (7) siendo el numero perfectamente neutro.
Siendo una escala logaritmica, cada número entero tiene una diferencia de 10 veces en la concentración de hidrógeno del número anterior o el siguiente. Cuanto más bajo es el pH, más ácida es la sustancia. Cuanto más alto es el pH, más básica o alcalina es la sustancia.
Factores que elevan el pH
Entonces, por qué el pH tiende a elevarse? Puede notar que el pH casi nunca baja de manera natural con el tiempo... y eso debe de ocurrir por alguna razón verdad?. Bueno, varias razones, y a veces una combinación de esas razones. Así que hablemos de algunas de ellas.
1. Aumento natural del pH: pérdida de dióxido de carbono
La química del pH parece mucho más complicada de lo que en realidad es. En las piscinas, gracias al uso de la alcalinidad, el movimiento del pH se basa principalmente en la cantidad de dióxido de carbono (CO2) disuelto en el agua. Dicho gas tiende a abandonar el agua naturalmente en busca de equilibrio como lo establece la ley de Henry. Por otra parte, cuando el CO2 se incrementa en el agua, este se disuelve y se convierte en ácido carbónico (H2CO3), parte fundamental del sistema de alcalinidad.
H2O + CO2 → H2CO3
Agua + dióxido de carbono = ácido carbónico
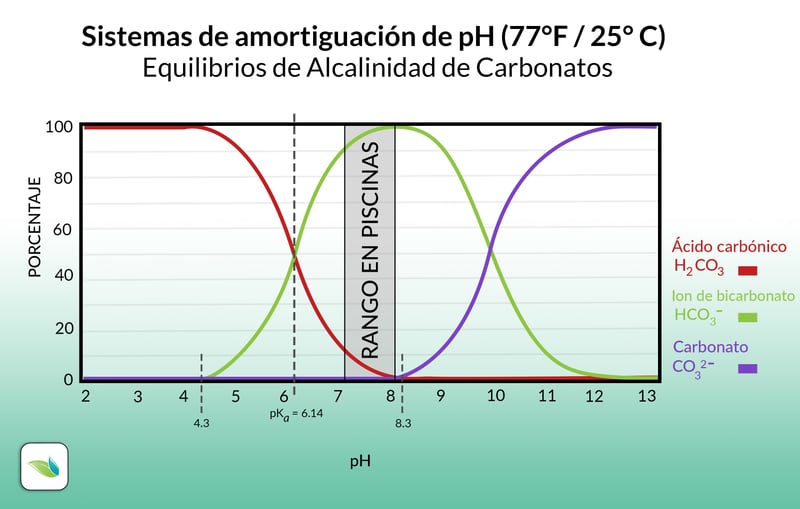
Observemos el siguiente gráfico:
Este gráfico nos muestra cómo funciona el sistema de alcalinidad de carbonatos en una piscina. Mismo sistema que se encarga de neutralizar sustancias ácidas para de esa manera prevenir que el pH fluctue negativamente hacia un extremo corrosivo o un extremo de baja saturación del ISL.
Podemos observar como el equilibrio de las diferentes partes del sistema entre el acido carbónico, el ion de bicarbonato y el ion de carbonato está regido también por el pH. Entre más bajo sea el pH por ejemplo, más acido carbónico existirá en el agua el cual no tiene en realidad más capacidad de neutralización. Es por eso que cuando se alcanza un pH de 4.3, se dice que se tiene 0 alcalinidad, algo no muy deseado en una piscina, excepto por ciertas excepciones.
Como anteriormente mencionados, más CO2 significa más acido carbónico y viceversa, lo que empuja el equilibrio hacia la izquierda, en otras palabras reduce el nivel del pH. Cabe mencionar que esta manipulación del gas no tiene impacto efectivo en el nivel de alcalinidad por un par de razones. Una de ellas es que este gas se escapara nuevamente hacia el ambiente debido a que el aire que respiramos tiene muy poca concentracion de dioxido de carbono, este equilibrio es definido por la ley de Henry de los gases y la siguiente ilustración es una representación muy básica del fenómeno.
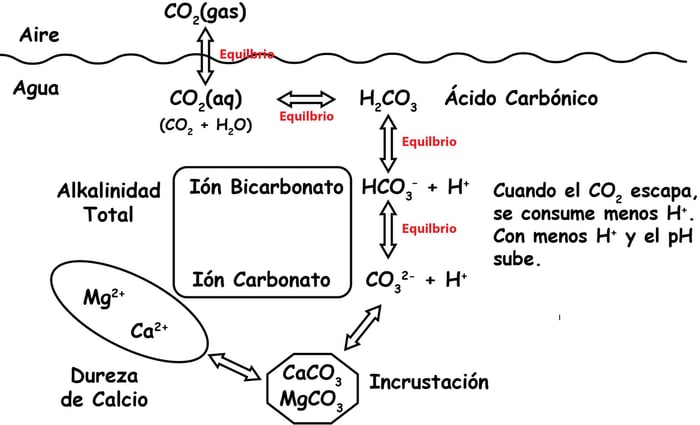
La Ley de Henry
De manera natural el CO2 tiende a buscar el equilibrio entre la superficie del agua y el aire del ambiente. Por lo tanto, el CO2 se libera hasta que se encuentra en un equilibrio relativo con el aire sobre la piscina. A este fenómeno le conocemos como la ley de Henry. Pero no se angustie, ni siquiera nosotros teníamos idea de lo que era la Ley de Henry y cómo se aplicaba en nuestro campo...aunque ahora todo tiene mucho sentido. Las sustancias ácidas reducen el pH y la alcalinidad y el pH vuelve a subir tarde o temprano pero la alcalinidad no, por qué es esto?
Lo que sucede es que las sustancias ácidas convierten los iones de bicarbonato y carbonato en acido carbónico durante el proceso de neutralización el cual en consecuencia incrementa la concentración de CO2 y de esta manera afecta los equilibrios. Una vez que el gas se escapa nuevamente, el pH vuelve a subir mientras que la alcalinidad tiene que ser repuesta con iones de bicarbonato o carbonato, como se hace con bicarbonato de sodio y carbonato de sodio.
Las buenas noticias son que el pH no sube indefinidamente, si no que tiene un nivel al cual llega en un equilibrio con el ambiente. Algo que nosotros bautizamos como el techo del pH, este depende del nivel de alcalinidad inicialmente y la temperatura del agua:
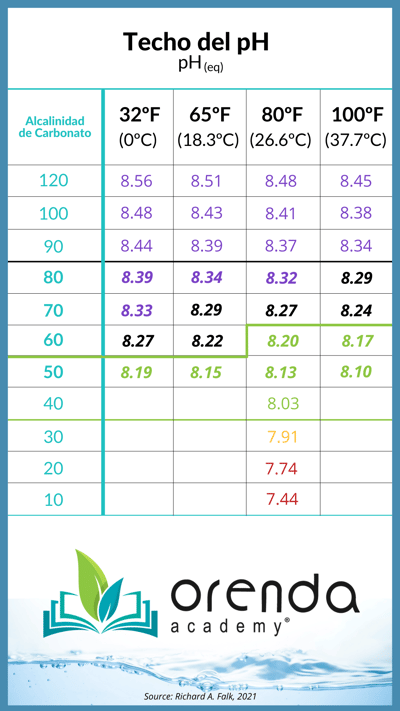
Fuente: Richard A. Falk. Los valores del gráfico son para diversas temperaturas del agua (ºF).
Cotidianamente cuando se maneja una alcalinidad entre 80 y 120 ppm, estándares establecidos en nuestra industria por décadas, el pH es más difícil de contener debido a que el techo del pH es mas alto. Esto es remarcable, porque cuando el pH supera los 8.3, es más fácil para el calcio precipitarse y formar sarro con el carbonato (el ISL es demasiado alto, por lo general).
Esto es parte de la razón por la que en Orenda recomendamos un nivel más alto de dureza del calcio y una alcalinidad un poco más baja, entre 60 -90 ppm, en lugar de hasta 120 ppm. Esto le permitirá procurar el equilibrio del ISL, conteniendo el pH en lugar de controlarlo.
En conclusion, el pH tenderá a subir a su techo físico naturalmente, el cual es definido por la alcalinidad y la temperatura del agua. Factor que ahora ya se refleja en nuestra calculadora para el celular. Es importante saber que es posible encontrar al pH por arriba de su techo, pero generalmente esto es forzado u ocasionado de manera no natural (como al agregar químicos concentrados).
Las algas también elevan el pH del agua
Las algas consumen dióxido de carbono, lo cual lo elimina del agua. En efecto, este consumo de CO2 eleva el pH, y si existe una gran cantidad de algas en la piscina, el pH puede subir muy por arriba de 8.2. Podemos confirmar esto por experiencia personal, porque medimos el pH con una sonda digital que leyó 10.3 de pH! mientras limpiabamos una piscina verde. (Video en inglés por Eric Knight)
2. Desinfectantes y su impacto en el pH
Cada tipo de desinfectante tiene un impacto en relación con el pH en la piscina, y el pH depende del desinfectante utilizado. Por ejemplo, el cloro gaseoso y el tricloro son productos muy ácidos, lo que significa que tienen un pH muy bajo y tienden a reducir el pH de la piscina. El dicloro tiene un pH relativamente neutro, al igual que el bromo, por lo que su impacto en el pH es mínimo, si no despreciable. Los tipos de cloro no estabilizados populares como el hipoclorito de calcio (cal hipo) y el hipoclorito de sodio (cloro líquido) tienen un pH alto, por lo que tienden a elevar el pH de la piscina, aunque en este caso el impacto en el pH es temporal.
Porque los generadores de cloro salino elevan el pH
Los sistemas de sal pueden ser complicados debido a que mantienen un pH más alto de lo normal. Solíamos pensar que se debía a la constante producción de hidróxido de sodio (NaOH). Cuando en realidad este subproducto es mayoritariamente neutralizado en términos de pH con el pH bajo del cloro gas producido (Cl2). La reacción se observa de la siguiente manera:
2NaCl + 2H2O + ⚡️→ Cl2⇡ + 2NaOH + H2⇡
sal + agua + ⚡️→ cloro (gas) + hidroxido de sodio + hidrogeno (gas)
En realidad, el pH tiende a ser más elevado debido a la producción de hidrógeno gas. Es importante remarcar que hidrógeno gas (H2) y los iones de hidrógeno (H+) no son lo mismo. El aumento del pH ocurre por que este gas produce burbujeo y agitación acelerando así la pérdida del dióxido de carbono (CO2) lo cual permite que el sistema llegue al techo del pH mas rapidamente.
Los diferentes tipos de cloro de verdad tienen un impacto en el pH
Un hábito común en el negocio de las piscinas es agregar algo de ácido para "compensar" el aumento de pH que causa por ejemplo el cloro líquido. Pero según el reconocido experto en química de piscinas Robert Lowry en su libro Pool Chemistry for Service Pros (página 9), cuando el cloro líquido entra al agua, en realidad no elevará el pH tanto como se podría imaginar.
Las reacciones del cloro líquido crean subproductos con alto pH (hidróxido de sodio, NaOH) y pH bajo (ácido clorhídrico, HCl), que se neutralizan entre sí. El cambio neto de pH debe ser aproximadamente cero. Lo mismo ocurre con el hipoclorito de calcio (Hipocal)
.jpg?width=1920&height=1080&name=Self%20neutralization%20of%20the%20different%20types%20of%20chlorine%20(spanish).jpg)
Ademas, el desinfectante solo se usa en unas pocas partes por millón, por lo que incluso si hay un cambio neto de pH, no siempre es un gran problema. El tricloro, el que generalmente se utiliza en tabletas, es una excepción debido a que gracias a su acidez constantemente reducirá los niveles de pH y alcalinidad con su uso.
3. Productos químicos para ajustar el pH y alcalinidad
Algunas instalaciones utilizan la inyección de CO2 para el mantenimiento y la reducción del pH con el beneficio agregado de no reducir la alcalinidad. Con el tiempo sin embargo, esto provoca un incremento en la alcalinidad total.
De otra manera, la alcalinidad total en una piscina es elevada con carbonato de sodio (Na2CO3) o bicarbonato de sodio (NaHCO3). Ambos químicos aumentan la alcalinidad, pero el carbonato de sodio, también conocido como ceniza de soda, tiene un impacto más fuerte en el aumento del pH debido a que es un producto más alcalino.
Cuando se agrega demasiado rápido o en demasiada cantidad sin diluir, a veces la ceniza de soda enturbia la piscina, esto debido a que el pH alcalino del producto, generalmente entre 11.4 y 11.6 eleva rápidamente el pH en una zona localizada y esto hace que esa área esté completamente sobresaturada, lo que provoca la precipitación repentina del calcio al combinarse con el carbonato.
Asegúrese de diluir y distribuir uniformemente alrededor de la piscina, y dosificar con cuidado para evitar este fenómeno. Si ya ha ocurrido, es cuestion de esperar, circular y reajustar el pH si es necesario para regresar el calcio y por ende el precipitado a la solución.
4. Sobre-corrección del pH
Este es un verdadero problema y lo peor de todo es que en piscinas con acabado cementoso, el abuso de un producto químico para reducir el pH siempre termina haciendo que el pH rebote y se eleve nuevamente.
La cuestión es que la mayoría de las personas no tienen el buen hábito de medir los químicos... y obviamente que la medición de los químicos y su dosificación apropiada también depende del tamaño de la piscina o en otras palabras el volumen del cuerpo de agua, el cual es otro parámetro que por desgracia es comúnmente ignorado o simplemente no medido. Generalmente se deriva de la estimación.
El calcular el volumen de su piscina lo más preciso posible es importante por que le dará la oportunidad de dosificar los productos químicos y ajustar la química de la piscina efectivamente. El agregar los productos químicos en exceso aumenta la probabilidad de causar desbalances no deseados. Especialmente con los productos ácidos para reducir el pH lo que ocurre es que el acido se agrega en exceso y sin diluir. El acido muriático al 31.45% por ejemplo es más pesado que el agua, por lo cual se va directamente al fondo.
 Ácido muriatico con colorante agregado sin diluir. Credito de onBalance
Ácido muriatico con colorante agregado sin diluir. Credito de onBalance
Cuando el acido muriático llega al fondo de una piscina con acabado cementoso, empieza a corroer o disolver el calcio del acabado, en la mayoría de los casos de manera inadvertida. Este calcio al mezclarse con el agua crea hidróxidos, sustancias alcalinas que hacen que el pH rebote y vuelva a subir.
De este fenómeno de hecho se han desarrollado ciertos mitos con la noción que agregar el acido de manera concentrada en un lugar en específico reduce únicamente la alcalinidad pero no el pH. Esto ocurre por las razones anteriormente mencionadas. Está de sobra mencionar que NO es una práctica recomendada.
¿Por qué aumenta el pH durante el arranque o llenado inicial de la piscina?
Cuando se ha recién aplicado el acabado cementoso en una piscina y se ha hecho el método de exposición, generalmente es tiempo de llenarla con agua. El agua proveniente de la llave en la mayoría de los casos tiene una muy baja saturación del ISL, gracias a que conlleva bajos niveles de alcalinidad y calcio.
Cuando el agua y el acabado entran en contacto, el cemento comienza a hidratarse, curarse y endurecerse. Sin embargo el agua agresiva o en otras palabras con baja saturación, comienza a extraer ese calcio de las paredes, arruinando de cierta manera la densidad y la calidad del acabado. El calcio al disolverse en el agua eleva el pH en cuestión de horas, a veces de manera extraordinaria y esto desafortunadamente pretende arreglarse con el químico más perjudicial para un acabado nuevo, el acido.
Aprenda más acerca del procedimiento adecuado y los fenómenos que se pueden presentar con nuestro curso educativo Orenda Startup Academy, el llenado inicial de piscina. Es completamente gratis!
Bonus: Por que el pH está bajo?
En la mayoría de los casos la lucha está en tratar de bajar el pH. El ciclo vicioso de bajarlo con productos ácidos y al mismo tiempo reducir la alcalinidad solo para verlo subir y repetir el proceso, mientras que después tenemos que reponer la alcalinidad.
Sin embargo hay ocasiones en las que puede encontrar el pH demasiado bajo y su intención sería subirlo. Lo primero que tiene que saber es que en piscinas con acabado cementoso y alcalinidad, el pH bajo promueve baja saturación del carbonato de calcio o del ISL lo que implica que el agua disolverá el acabado y por si misma encontrara el equilibrio del pH hacia el lado superior.
En piscinas con otros tipos de acabado como de fibra de vidrio o de vinilo, desafortunadamente el pH no se reajustará por sí mismo, lo cual implica agua corrosiva por más tiempo y también degradación en el acabado y en el equipo.
El truco está en evitar niveles bajos de pH continuamente para prevenir el daño. Como ya lo vimos, el tener alcalinidad en su piscina garantiza la existencia de CO2, lo que también significa que permite que el pH suba. Si esto no ocurre la unica explicacion es la constante adición de sustancias ácidas al agua.
Estas sustancias pueden provenir del ambiente, de la lluvia, y de la naturaleza, pero debido a que estos contaminantes son esporádicos, es casi seguro asumir que una supresión constante del pH tiene más que ver con los productos químicos utilizados en el mantenimiento rutinario de la piscina.
Productos químicos que reducen el pH
Cualquier producto químico lo suficientemente acido tendrá un impacto negativo tanto en el pH como en la alcalinidad. Entre los más populares se encuentran las tabletas de tricloro, que con su abuso continuamente suprimen el pH y la alcalinidad. Es importante tener conciencia de los productos químicos que utiliza para el mantenimiento y cómo pueden estos ser conflictivos.
Existen varios tipos de ácido. Los más comunes son ácido muriático (o clorhídrico) líquido y ácido sulfúrico. Luego también hay un ácido seco llamado bisulfato de sodio. Las personas tienen sus preferencias, pero todas estas sustancias reducen tanto el pH como la alcalinidad.
Conclusión
Hay muchos factores que afectan el pH (y la alcalinidad), y siempre hay una razón para el cambio. El aprendizaje principal de este artículo debería de ser el reconocer como el CO2 tiene un impacto significativo en el pH de la piscina, y debido a que el aire en el ambiente tiene menos del 1% de este gas, el pH en las piscinas que cuentan con alcalinidad siempre (o casi siempre) tenderá a subir naturalmente. También como lo mencionamos el pH puede suprimirse de manera no natural. En Orenda promovemos la práctica de contención del pH en lugar de intentar controlarlo.
Si está cansado de luchar contra la química del agua para estabilizar el pH, esperamos que este artículo le ayude a comprender lo que realmente está sucediendo.